
NEWS
新闻中心
SERVERS
服务项目
发布时间:2023-05-18

编者按:今天,我们特别回顾一项于2020年3月1日发表在《CLINICAL CANCER RESEARCH》的经典研究——《Organoid Cultures as Preclinical Models of Non-Small Cell Lung Cancer》,该研究利用患者肿瘤组织和患者来源的异种移植模型(PDX)构建非小细胞肺癌(NSCLC)类器官,并鉴定NSCLC类器官与患者肿瘤的基因组学和生物学的一致性,证实类器官是药物测试和生物标志物验证的潜在平台。
一、研究背景
非小细胞肺癌(NSCLC)是全球癌症相关死亡的主要原因,5年总生存率仅15%[1]。在过去的几十年中,人们在开发NSCLC的临床前模型方面付出了巨大的努力,包括二维(2D)细胞系、基因工程小鼠模型(GEMM)和患者来源的异种移植物(PDX)。这些模型的应用加速了我们对NSCLC生物学和发病机制的理解。尽管细胞系仍广泛用于临床前研究,但它们通常不能反映其原始肿瘤的生物学特征或患者肿瘤对靶向治疗的药物敏感性[2]。此外,尽管GEMM和临床相关的PDX可能更接近患者体内的药物应答反应,但使用这些模型的研究需耗费大量时间和费用[3]。因此,今日介绍的这项研究的目标是开发源自NSCLC和PDX组织的新型临床前模型,并且新模型需具有经济、快速、准确反映疾病的生物学等优势。
在过去几年中,源自原发性患者肿瘤和各种癌症(包括结肠癌、胰腺癌、前列腺癌、肝癌和乳腺癌)PDX的类器官模型,相继被报道。这些肿瘤类器官已被广泛应用于药物筛选和生物标志物鉴定等领域[4-7]。并且,在患者来源的类器官(PDO)上的药物筛选结果与对应患者体内的应答情况高度一致[8]。此外,一些研究已经能够培养来自小鼠和人类的正常肺类器官[9],这些类器官由多种类型的气道细胞组成,以了解正常肺部的发育和功能。最近的研究也显示,科研人员已能够成功构建NSCLC类器官[10-12]。然而,这些研究中的NSCLC类器官是短期培养的,但缺乏类器官肿瘤细胞纯度的系统研究,并且没有提供有关模型长期生长的具体细节[11,12]。因此,仍然需要开发适用于NSCLC药物筛选和生物标志物鉴定的NSCLC类器官平台。
今日分享的这项研究能够分别利用肺癌的原发肿瘤组织和PDX组织,构建产生短期(1-3个月,1-9代)和长期(>3个月,>10代)培养的NSCLC类器官,成功率为88%(57/65)。本研究证明了在体外短期和长期建立的NSCLC类器官都具有其匹配肿瘤组织的组织学特征和致瘤性。全外显子组测序(WES)和RNA测序显示,长期NSCLC类器官尽管在体外环境中多次传代生长,但仍保留了其亲本肿瘤的基因突变、拷贝和基因表达。最后,本研究证明了NSCLC类器官可用于药物测试,表明其在疾病建模和治疗测试中具有应用潜力。
二、研究结果
1. NSCLC患者肿瘤和PDX来源的类器官建立

图1 NSCLC类器官的建立和短期培养类器官的表征
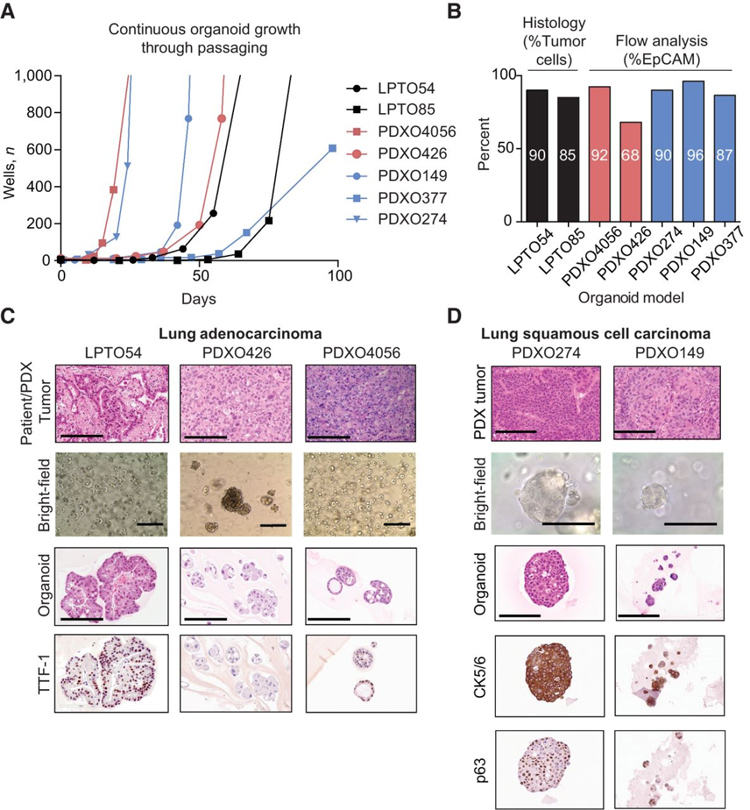
图2 长期培养类器官的组织学和生长表征
本研究从2015年到2017年共处理了19例手术切除的肺腺癌(LUAD),15例肺鳞状细胞癌(LUSC),16例LUAD PDX和26例LUSC PDX用于类器官的建立。其中88%(57/65)成功培养为类器官,72%(47/65)的模型表现可短期培养(第1-9代,1-3个月),15%(10/65)的模型实现了长期培养。为了确定PDO中的肿瘤纯度,本研究通过H&E和IHC对类器官和原始患者肿瘤的肺标志物TTF-1和TP63进行了细胞学评估,结果显示,PDO和PDX来源的类器官(XDO)模型均未被正常细胞大量污染,分别有75%~97%和50%~90%的细胞为肿瘤细胞。最后,本研究无法通过组织学评估在短期类器官培养中检测到成纤维细胞和免疫细胞的存在。
此外,本研究表明,类器官反映了其亲本肿瘤的TTF-1和TP63染色模式,表明它们概括了亲本肿瘤的组织学。并采用短期类器官模型评估了临床批准的EGFR靶向治疗NSCLC的疗效,即在三个 EGFR 野生型和一个 EGFR 外显子19缺失的类器官模型中评估了 EGFR 抑制剂厄洛替尼,证明了短期类器官含有足够的细胞数用于药物测试,并可用作生物标志物验证的临床前模型。
本研究表明,在长期培养的类器官中,没有被正常或非人类细胞侵染。PDO由超过85%的肿瘤细胞组成,大多数XDO含有超过65%的EpCAM+细胞,在所有长期类器官模型中均有<8%的H2K阳性细胞。此外,长期建立的NSCLC类器官也保留了其亲本肿瘤的组织学特征。
2、NSCLC类器官保留了其亲本肿瘤的基因突变和拷贝数功能
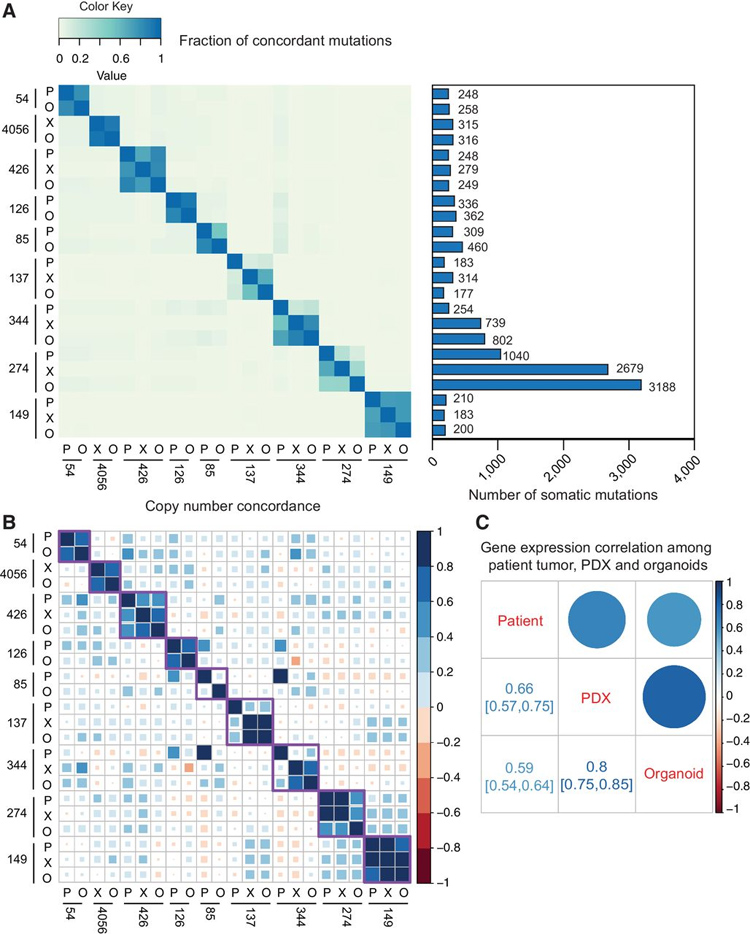
图3 类器官和匹配的患者肿瘤/PDX 的突变、复制数和转录组
为了评估类器官与其来源组织的遗传特征一致性,本研究通过WES比较了九种长期类器官培养物与其亲本肿瘤之间的体细胞突变谱和复制数变异。研究表明,类器官与其匹配的患者肿瘤和/或 PDX 组织之间的突变谱高度一致,说明培养条件不会破坏肿瘤基因组的稳定性。拷贝数变异(CNV)分析也表明在类器官培养过程中,亲代肿瘤的 CNV 谱基本保留。
为了确定类器官中是否保留了原有肿瘤组织的基因表达谱,该研究对9个匹配的类器官及对应的组织和/或 PDX 肿瘤的基因表达进行了 RNA-seq 分析。研究人员将两种分型( LUAD 和 LUSC )的原代肺癌组织而来的PDX进行人特异性微阵列芯片,获得的数据作为对照。将类器官基因表达谱与上述对照基因表达谱对比,研究者确定患者肿瘤和类器官之间的总体基因表达相关性是0.59,而 PDX 和类器官是0.8。此外,六个 XDO 中的五个和三个 PDO 中的一个之间的基因表达与其衍生类器官的匹配肿瘤组织之间的相关性高于任何其他类器官模型。总的来说,分子数据表明,体外生长条件能够使类器官肿瘤细胞在很大程度上维持其亲本肿瘤的关键分子特性。
3、长期NSCLC类器官在药物测试中的效用

图4 长期培养的NSCLC类器官用于药物测试
为了探索长期培养的NSCLC类器官在药物测试中的效用,研究人员调查了五个具有良好特征的潜在敏感的生物标志物改变的长期培养类器官模型的基因组数据。在患者、PDX和编号为“PDXO426”的类器官中检测到 KRAS G13C突变和扩增。
KRAS突变细胞系的临床前研究表明,与 KRAS 野生型细胞系相比,含有这种突变的肿瘤细胞可能对MEK抑制剂更敏感。为了确定PDXO426类器官中的KRAS 突变和扩增是否增强了其对 MEK 抑制剂曲美替尼的敏感性,本研究将其与没有KRA突变的其他三种类器官模型进行比较。结果显示,KRAS突变体PDXO426对 MEK 抑制剂曲美替尼(IC50 = 0.05 mmol/L)比其他三种具有野生型细胞系的类器官更敏感。MEK抑制剂司美替尼也产生了类似的结果。为了证实 PDXO426中的KRAS改变特异性地增强了其对靶向治疗的敏感性。研究者还检测了这四种类器官模型对EGFR抑制剂阿法替尼的应答情况。正如预期的那样,相对于HCC827细胞系(已知有EGFR突变,对EGFR抑制剂有应答),四种类器官模型中没有一种对阿法替尼有应答。
为了确定由PDXO426类器官模型显示的特异性MEK抑制剂敏感性是否反映其来源的 PDX肿瘤的生物学特性,本研究评估了PDXO426的来源PDX模型对曲美替尼的敏感性。PDXO426 PDX表现出曲美替尼敏感性,而KRAS野生型PDXO274 PDX则具有耐药性。总的来说,这些结果支持类器官作为临床相关的肿瘤患者的替代品进行药物测试。
4、NSCLC类器官用于联合疗法测试
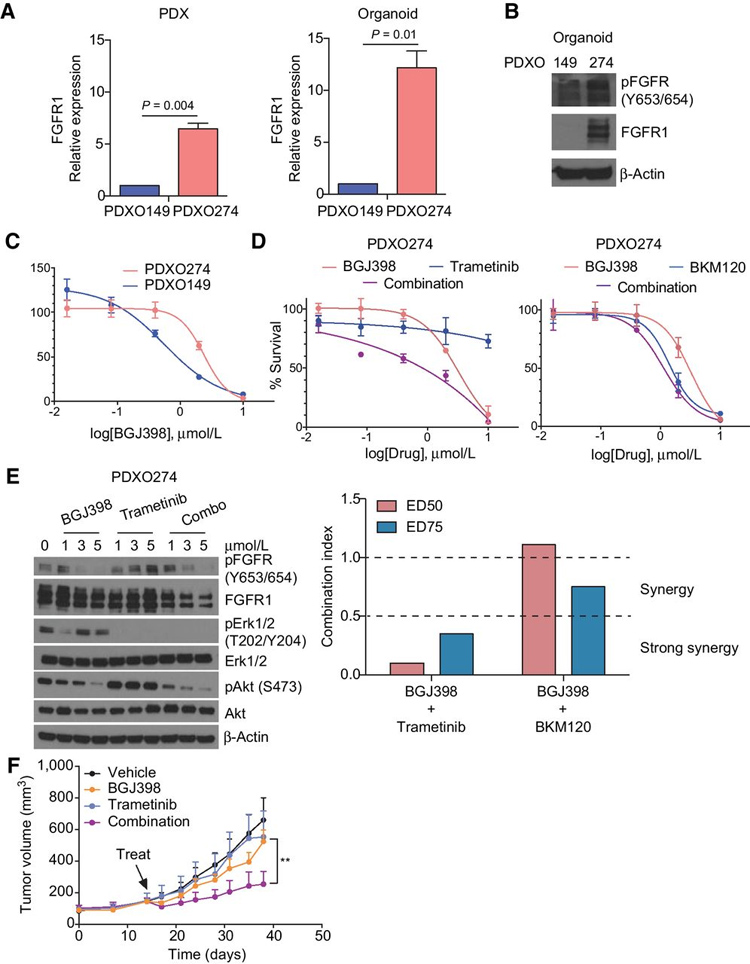
图5 FGFR1和MEK抑制剂在LUSC类器官模型中的组合
本研究接下来探讨了NSCLC类器官是否也可以用作发现新的生物标志物和联合疗法的工具。通过RT-qPCR和Western分析获得的FGFR1 mRNA和蛋白质定量显示,相对于 PDXO149(FGFR1野生型) ,PDXO274表现出超过10倍的FGFR1 mRNA表达和更高的磷酸化FGFR1和总FGFR1蛋白表达。
这些结果表明,在PDXO274类器官模型中,FGFR1相关通路激活,是一个FGFR1扩增的类器官模型,这意味着患者对 FGFR抑制剂的应答率可能会降低。FGFR抑制剂 BGJ398的体外药物测试显示 PDXO274对 FGFR 抑制剂基本不敏感。在研究MEK和PI3K抑制剂与FGFR抑制剂联合治疗FGFR异常癌症的有效性的基础上,本研究在 FGFR1扩增的类器官模型中测试了曲美替尼和 PI3K 抑制剂BKM120与BGJ398。在BGJ398和曲美替尼组合中观察到强协同作用(组合指数 < 0.5) ,而在 BGJ398和BKM120组合中观察到弱协同作用(组合指数 > 0.5)。
此外,尽管单药 BGJ398抑制pFGFR和pAkt,并且单药曲美替尼仅抑制pErk,但是通过两种化合物的组合实现了所有三种磷酸蛋白的靶向抑制。曲美替尼和BGJ398组合的功效在PDXO274的亲本PDX中进一步体内验证,这进一步支持了早期的论点,即类器官模型可以保留其来源肿瘤组织的靶向治疗敏感性。总的来说,可以使用类器官和PDX模型进行药物研究,这将大大提高临床应答率。
三、编者点评:
本研究建立了一个从患者肿瘤和患者来源的异种移植模型中构建NSCLC类器官的方案。重要的是,研究者发现这些类器官保留了其亲本肿瘤的组织学和分子特征,并证明了它们在药物测试中的实用性。该类器官平台提供了NSCLC临床前模型,可能有助于未来的药物筛选生物标志物鉴定。
作为斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展科研及研发服务、智慧实验室建设和精准医疗三大业务。目前,环特类器官平台已成功搭建多种肿瘤类器官的培养平台,已有多种肿瘤类器官培养试剂盒和试剂在售,即将推出药物毒性检测服务,敬请期待!
参考资料:
[1] Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, et al Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015;136:E359–86.
[2] Gillet JP, Varma S, Gottesman MM. The clinical relevance of cancer cell lines. J Natl Cancer Inst 2013;105:452–8.
[3] Jung J, Seol HS, Chang S. The generation and application of patient-derived xenograft model for cancer research. Cancer Res Treat 2018;50:1–10.
[4] Pauli C, Hopkins BD, Prandi D, Shaw R, Fedrizzi T, Sboner A, et al Personalized in vitro and in vivo cancer models to guide precision medicine. Cancer Discov 2017;5:462–77.
[5] Schutte M, Risch T, Abdavi-Azar N, Boehnke K, Schumacher D, Keil M, et al Molecular dissection of colorectal cancer in pre-clinical models identifies biomarkers predicting sensitivity to EGFR inhibitors. Nat Commun 2017;8:14262.
[6] Aurora M, Spence JR. hPSC-derived lung and intestinal organoids as models of human fetal tissue. Dev Biol 2016;420:230–8.
[7] Nadkarni RR, Abed S, Draper JS. Organoids as a model system for studying human lung development and disease. Biochem Biophys Res Commun 2016;473:675–82.
[8] Sachs N, de Ligt J, Kopper O, Gogola E, Bounova G, Weeber F, et al A living biobank of breast cancer organoids captures disease heterogeneity. Cell 2018;172:373–86.
[9] Dye BR, Hill DR, Ferguson MAH, Tsai Y, Nagy MS, Dyal R, et al In vitro generation of human pluripotent stem cell derived lung organoids. eLife 2015;4:1–25.
[10] Dijkstra KK, Cattaneo CM, Weeber F, Chalabi M, van de Haar J, Fanchi LF, et al Generation of tumor-reactive T cells by co-culture of peripheral blood lymphocytes and tumor organoids. Cell 2018;174:1586–98.
[11] Neal JT, Li X, Zhu J, Giangarra V, Grzeskowiak CL, Ju J, et al Organoid modeling of the tumor microenvironment. Cell 2018;175:1972–88.
[12]Sachs N, Papaspyropoulos A, Ommen DDZ, Heo I, Bottinger L, Klay D, et al Long-term expanding human airway organoids for disease modeling. EMBO J 2019;38:pii: e100300.