
NEWS
新闻中心
SERVERS
服务项目
发布时间:2023-08-11

编者按
在肠道类器官发生过程中,相同潜能的上皮祖细胞成熟为表型独特的干细胞,负责组织的终身维持。尽管从胎儿到成人肠道转变过程中的组织学和形态学变化已得到了很好的表征,但这一过程在分子水平上的变化很大程度仍然未知。
2023年7月12日,《Science Advances》杂志发表了最新研究论文。该研究基于肠道类器官,利用RNA表达、染色质可及性、DNA甲基化和三维染色质构象分析技术的组合,来定义两种发育状态的转录和调控景观,发现胎儿和成人上皮细胞在转录上是不同的,调控元件的活性跟随局部染色质可及性和DNA甲基化水平发生变化;同时,研究人员还发现细胞外基质组分的表达变化和YAP信号的激活是胎儿到产后过渡的候选调节机制。该研究为探索组织成熟的决定因素提供了框架,并有助于阐明组织成熟、修复和肿瘤形成的保守机制。
一、 研究背景
胎儿肠道经扩张和重塑后形成了初级绒毛和绒毛间隙[1, 2],随后等位上皮祖细胞产生功能明确的成体干细胞[3, 4],这些干细胞在出生后被限制于肠隐窝的底部,在整个生命过程中负责肠上皮的补充[5]。已知成体肠道上皮干细胞经培养可形成出芽类器官,包含隐窝和绒毛样结构域,部分再现了成体上皮的形态和细胞组成[11]。
而相同条件下培养的胎儿祖细胞形成肠囊状球体,它主要由未分化的祖细胞组成,不能在体外自然成熟。将其进一步移植到成体肠道壁龛后,胎儿类器官则可以分化出多种成熟细胞[4, 11, 12],这表明它们在体外的不成熟状态是由细胞内在机制维持的。尽管从胎儿到成人肠道转变过程中的组织学和形态学变化已被广泛描述[4, 6-10],但这一过程在分子水平上的变化很大程度仍然未知。
在本研究中,研究人员基于肠道类器官,利用RNA表达、染色质可及性、DNA甲基化和三维染色质构象分析技术的组合,来定义两种发育状态的转录和调控景观,发现胎儿和成人上皮细胞在转录上是不同的,调控元件的活性跟随局部染色质可及性和DNA甲基化水平发生变化;同时,研究人员还发现细胞外基质组分的表达变化和YAP信号的激活是胎儿到产后过渡的候选调节机制。该研究为探索组织成熟的决定因素提供了框架,并有助于阐明组织成熟、修复和肿瘤形成的保守机制。
二、 研究结果
1、胎儿和成体肠道类器官转录组不同
在相同培养体系下,基于胎儿和成年小鼠小肠近端组织体外3D培养,形成胎儿肠球(FEnS)和成体类器官(aOrg)。对两种体系中转录起始位点(TSS)的全基因组活性进行分析,结果显示在mRNA水平上存在35%的基因差异表达。GO分析表明,FEnS中上调的mRNA富集在细胞表面受体信号传导、运动、发育和粘附途径中,而aOrg中上调的基因大多富集在代谢途径。体内胎儿和成人特异基因组分别在FEnS和aOrg特异基因中显著富集。这些结果表明,虽然培养条件相同且形态相似,但胎儿上皮细胞和成体上皮细胞的3D培养物显示出不同的转录程序,反映了它们最初的发育状态。
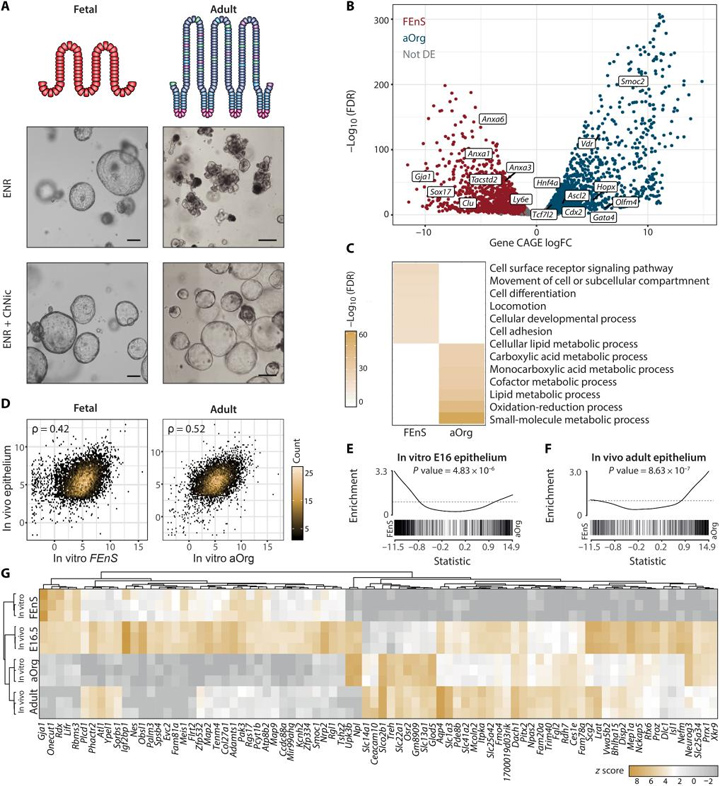
图1
2、胎儿期和成年期具有不同的增强子和启动子景观
为了探索转录差异背后的机制,将测序数据与转座酶可及染色质测序(ATAC-seq)相结合来表征FEnS 和aOrg中的增强子和启动子景观。
约90%CAGE读取位于ATAC-seq峰内,与没有CAGE信号的ATAC-seq峰相比,ENCODE染色质免疫沉淀测序转录因子(TF)峰在增强子候选区域富集,表明这些是功能元件;其中13%基因有一个或多个替代启动子。在FEnS和aOrg之间已注释的活跃启动子中有17.8%在FEnS中显著上调,19.5%在aOrg中显著上调;在eRNA表达方面,有23%候选增强子在FEnS中上调,29%候选增强子在aOrg中上调。由于eRNA表达已被证明与增强子活性相关,以上观察结果均表明调控元件的特定状态活性是胎儿与成年状态之间巨大基因表达差异的基础。
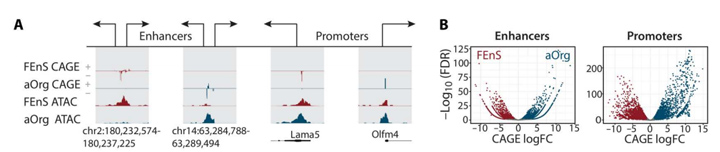
图2
3、染色质可及性和CpG甲基化变化反映了增强子和启动子子集的转录变化
研究人员观察到大多数CpG稀疏启动子在FEnS和aOrg之间存在差异表达,而只有32%的CpG密集启动子存在差异表达。CpG稀疏启动子和增强子染色质可及性(ATAC信号)的变化与基因表达(CAGE)变化密切相关,而CpG密集的启动子中只观察到弱相关性。且两种状态下,无论表达如何,差异表达的启动子中都观察到高ATAC信号。因此,研究人员得出结论,增强子区域和低CpG密度启动子的染色质可及性在发育状态下受到动态调节,并与表达变化共同发生。
考虑到动态染色质可及性与启动子GC含量之间的相关性,研究人员使用WGBS分析了FEnS和aOrg培养物之间CpG胞嘧啶甲基化的差异,发现增强子和CpG稀疏启动子的表达与甲基化之间存在很强的负相关,但CpG密集启动子的表达与甲基化之间存在微弱的负相关。差异甲基化区(DMRs)分析显示,38.5% aOrg特异性CpG -稀疏启动子在aOrg中被去甲基化,43.3% FEnS特异性启动子在FEnS中被去甲基化,而FEnS和aOrg特异性CpG密集启动子分别只有17.5%和13.7%被去甲基化。由于与eRNA表达状态相关的染色质可及性和DNA甲基化变化决定了每个发育阶段,只有少数启动子表现出特定状态的染色质变化,这些数据表明发育程序是由不同的增强子使用而不是局部启动子可及性的变化来调节的。
将原位脱氧核糖核酸酶(DNase)Hi-C与DNA甲基化分析相结合分析两种体系下的染色质变化,发现尽管整体染色质结构在很大程度上没有改变,但某些区域确实在胎儿和成年细胞之间切换了成分区域。
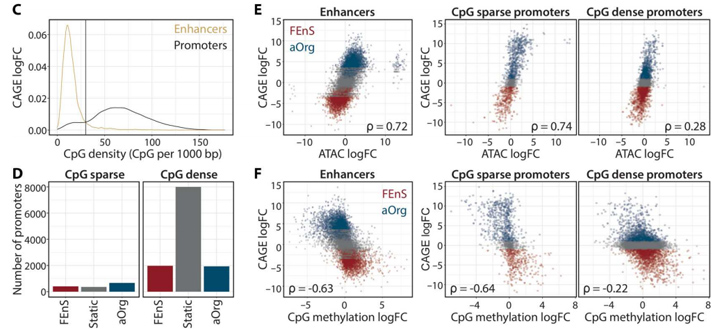
图3
4、胎儿祖细胞由持续高水平的YAP活性维持
FEnS特异性转录组高度富集了与肠上皮细胞YAP激活相关的转录特征,并高水平表达了YAP直接靶基因,与aOrg相比,FEnS中核(活性)YAP水平较高,而aOrg中核YAP信号仅限于芽域中较少的细胞。
与体内成人隐窝细胞相比,YAP相关转录特征在胎儿上皮细胞中更为丰富,在整个胎儿上皮中观察到了核YAP信号,体内仅在成人隐窝的下部局部观察到,这表明胎儿上皮在体外和体内均具有高YAP活性。研究者用YAP抑制剂verteporfin处理胎儿和成体培养物,观察到FEnS的生长更受到抑制剂的影响,表明胎儿细胞比成体细胞更依赖于YAP活性。
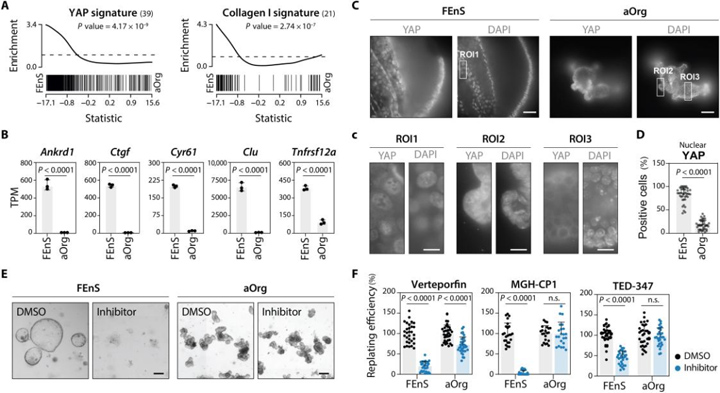
图4
在TetON-hYAP/H2B-mCherry小鼠品系中获取的成体类器官培养物中添加多西环素(DOX)诱导活性(S127A突变)YAP转基因的表达,导致aOrg生长为囊状、胎儿样圆形结构,表达高水平的胎儿特异性细胞表面标志物SCA1。在转录上,YAP过表达引起各种成体干细胞和分化标记下调,以及胎儿特异性基因标记的整体上调。然而,aOrg不能在含有DOX的ENR培养基中长期维持,表明仅激活YAP不足以驱动完全转化为自我维持的胎儿状态。
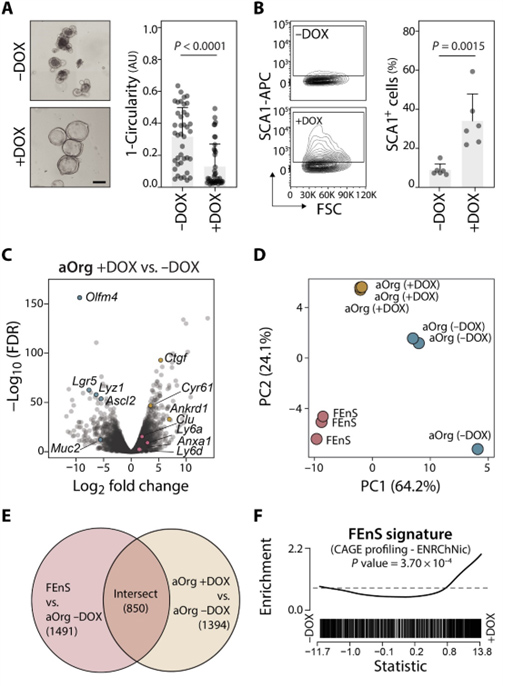
图5
利用胎儿和成体类器官的单细胞RNA测序分析,发现标准ENR培养基中的胎儿培养物中的一小部分细胞自发成熟为成体细胞。虽然YAP相关基因在大多数胎儿细胞中高度表达,但成熟细胞簇也显示出较低的特征富集,这表明成熟过程需要降低YAP活性。
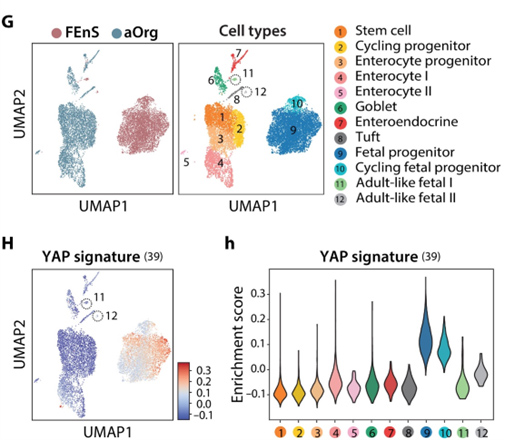
图6
5、不同的YAP活性水平与ECM基因的不同表达相关联
考虑到YAP作为一种机械反应因子的作用,ECM成分的差异表达被推测可能是其在胎儿和成人细胞中不同激活水平的基础。测序结果显示胎儿特异性基因在与细胞粘附和细胞表面受体相关的基因中高度富集。
与ECM相关基因中,各种层粘连蛋白亚基、胶原和纤连蛋白在胎儿细胞中的体外和体内表达水平都要高得多。在培养中测试药理学途径抑制剂的作用,与使用YAP抑制剂一致,相比于aOrg,胎儿培养物对FAK和SRC抑制剂的敏感性增加,进一步证实了活性YAP和上游信号通路对维持胎儿细胞的必要性。
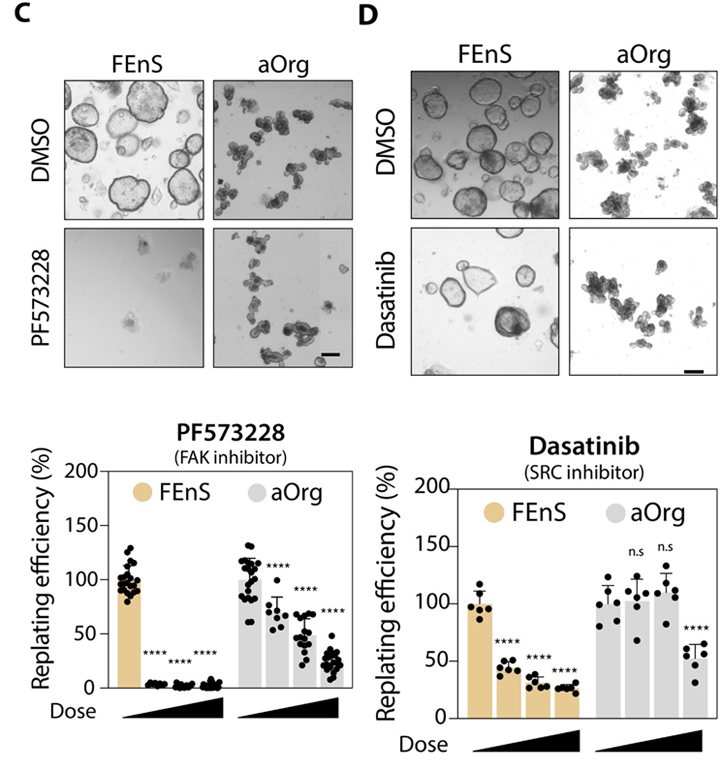
图7
作为全球斑马鱼技术应用的领导者,环特生物构建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务平台,开展科研及研究服务、智慧实验室建设和精准医疗三大业务。目前,环特类器官平台已成功搭建肠道等多种肿瘤及正常类器官的培养平台,已有多种肿瘤类器官培养试剂盒和试剂在售,欢迎各位读者垂询!
参考文献
[1] J. Guiu, K. B. Jensen, From definitive endoderm to gut-a process of growth and maturation. Stem Cells Dev. 24, 1972–1983 (2015).
[2] A. M. Chin, D. R. Hill, M. Aurora, J. R. Spence, Morphogenesis and maturation of the embryonic and postnatal intestine. Semin. Cell Dev. Biol. 66, 81–93 (2017).
[3] N. Barker, J. H. van Es, J. Kuipers, P. Kujala, M. van den Born, M. Cozijnsen, A. Haegebarth, J. Korving, H. Begthel, P. J. Peters, H. Clevers, Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature 449, 1003–1007 (2007).
[4] J. Guiu, E. Hannezo, S. Yui, S. Demharter, S. Ulyanchenko, M. Maimets, A. Jørgensen, S. Perlman, L. Lundvall, L. S. Mamsen, A. Larsen, R. H. Olesen, C. Y. Andersen, L. L. Thuesen, K. J. Hare, T. H. Pers, K. Khodosevich, B. D. Simons, K. B. Jensen, Tracing the origin of adult intestinal stem cells. Nature 570, 107–111 (2019).
[5] H. Gehart, H. Clevers, Tales from the crypt: New insights into intestinal stem cells. Nat. Rev. Gastroenterol. Hepatol. 16, 19–34 (2019).
[6] M. Bjerknes, H. Cheng, The stem-cell zone of the small intestinal epithelium. II. Evidence from paneth cells in the newborn mouse. Am. J. Anat. 160, 65–75 (1981).
[7] B.-M. Kim, J. Mao, M. M. Taketo, R. A. Shivdasani, Phases of canonical Wnt signaling during the development of mouse intestinal epithelium. Gastroenterology 133, 529–538 (2007).
[8] A. E. Shyer, T. R. Huycke, C. Lee, L. Mahadevan, C. J. Tabin, Bending gradients: How the intestinal stem cell gets its home. Cell 161, 569–580 (2015).
[9] K. D. Sumigray, M. Terwilliger, T. Lechler, Morphogenesis and compartmentalization of the intestinal crypt. Dev. Cell 45, 183–197.e5 (2018).
[10] M. Maimets, M. T. Pedersen, J. Guiu, J. Dreier, M. Thodberg, Y. Antoku, P. J. Schweiger, L. Rib, R. B. Bressan, Y. Miao, K. C. Garcia, A. Sandelin, P. Serup, K. B. Jensen, Mesenchymal-epithelial crosstalk shapes intestinal regionalisation via Wnt and Shh signalling. Nat. Commun. 13, 715 (2022).
[11] T. Sato, R. G. Vries, H. J. Snippert, M. van de Wetering, N. Barker, D. E. Stange, J. H. van Es, A. Abo, P. Kujala, P. J. Peters, H. Clevers, Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature 459, 262–265 (2009).
[11] R. P. Fordham, S. Yui, N. R. Hannan, C. Soendergaard, A. Madgwick, P. J. Schweiger, O. H. Nielsen, L. Vallier, R. A. Pedersen, T. Nakamura, M. Watanebe, K. B. Jensen, Transplantation of expanded fetal intestinal progenitors contributes to colon regeneration after injury. Cell Stem Cell 13, 734–744 (2013).
[12] R. C. Mustata, G. Vasile, V. Fernandez-Vallone, S. Strollo, A. Lefort, F. Libert, D. Monteyne, D. Pérez-Morga, G. Vassart, M.-I. Garcia, Identification of Lgr5-independent spheroid-generating progenitors of the mouse fetal intestinal epithelium. Cell Rep. 5, 421–432 (2013).