
NEWS
新闻中心
SERVERS
服务项目
发布时间:2023-10-07

编者按
肝细胞癌(HCC)已成为全球死亡率排名第三的肿瘤疾病,高通量测序显示TERT启动子、CTNNB1和TP53的突变是导致肝癌发生发展的主要原因。TERT启动子和CTNNB1上的突变热点赋予了显性的功能增益(GOF)活性,而HCC中的TP53通常与并发的功能丧失(LOF)畸变、蛋白改变的错义突变相关。研究表明p53突变体的肿瘤促进表型包括增强癌细胞的增殖和存活、上皮-间充质转化、凋亡逃逸以及体内肿瘤的启动能力,而其潜在的GOF机制可能是由于突变体干扰了其他蛋白质的结构改变或发挥了新的转录调控来激活下游致瘤途径、劫持慢性免疫信号、促进染色质重塑和调节选择性剪接事件。尽管TP53突变的发生被认为是HCC发展的早期事件,但直接研究p53 GOF突变在肿瘤早期作用的方法有限。
今天我们解读一项于2022年10月发表在《Hepatology》的最新研究,该研究使用人类肝脏类器官来模拟人类肝癌发生的早期阶段,从TP53丢失和L3环R249S突变位点引起病变。此外,HCC细胞系的染色质免疫沉淀测序对TP53缺乏导致肿瘤抑制功能丧失和突变p53获得功能活性导致HCC的发生提供了重要的功能见解。
一、主要研究成果
1、ChIP-seq揭示了L3突变体在染色质重塑和应激反应中的GOF作用
为了系统地评估HCC中TP53错义突变对转录激活的潜在影响,该研究对结合TP53及赖氨酸H3K27ac的全基因组进行了数据分析,并对4种TP53突变体(L3环及非L3环各两个)进行ChIP-seq。结果表明这四种突变体与TP53突变位点无关,WT TP53的全基因组结合大部分都丢失了,这意味着在TP53错义突变的肿瘤中,常规TP53转录活性的丧失很常见(图1E)。值得注意的是,与WT TP53和其他两个非L3环突变体相比,L3环突变体中只发现了一组TP53结合峰(图1E),意味着L3突变的独家转录调控。而R249S突变体存在特有的启动子-近端TP53结合峰,表明可能存在其他转录调控特性(图1E)。
为了确定这些TP53突变体的功能本体,该研究对三组TP53结合峰(即WT TP53相关峰、L3环相关峰和TP53R249S/−显性峰)进行了通路富集分析。结果显示WT TP53主要参与调节细胞凋亡、细胞周期和DNA损伤,这支持了TP53在HCC中的抑瘤作用。而TP53突变体则表现出不同的调控活性,L3环突变体同与染色质重塑和生物合成过程相关的基因结合(图1Gii),而TP53R249S/−则与应激反应和蛋白质修饰(图1Giii)相关途径有关。

图1
2、肝类器官中TP53KO和TP53R249S突变显示致瘤性
为了了解TP53KO和TP53R249S在HCC中的癌症启动作用,该研究利用新鲜的非肿瘤肝组织构建了三例肝类器官并构建TP53WT、TP53KO以及TP53R249S模型(图2A、2B)。Western Blot结果显示TP53KO以及TP53R249S类器官中TP53蛋白的丢失和获得(图2Ci,Cii);从形态学上看,TP53WT在单层隔间中保持了均匀性(图2D),而TP53KO和TP53R249S类器官则出现了明显的形态变化:增厚壁内陷进入管腔,多形性恶性特征,包括异型增生、高色、不典型和频繁的有丝分裂、极性丧失和核细胞质比增加(图2D)。与TP53WT类器官的导管结构相比,TP53蛋白缺失后形成了紧凑的类器官簇,R249S过表达的类器官在表面有大量的芽状突起(图2E),这与HCC类器官的生长模式非常相似。
值得注意的是所有TP53WT类器官在20代内都停止了生长(图2G),而TP53KO和TP53R249S类器官在繁殖过程中继续增殖和扩张,在超过50代中,每周的分裂率均为1:4(图2G)。由此评估了肝癌干细胞标志物CD44和CD133在三种肝类器官中的表达,结果显示与TP53WT相比,TP53KO和TP53R249S类器官中CD44和CD133的表达显著增加(图2H),表明癌症相关的细胞干性受到显著刺激。
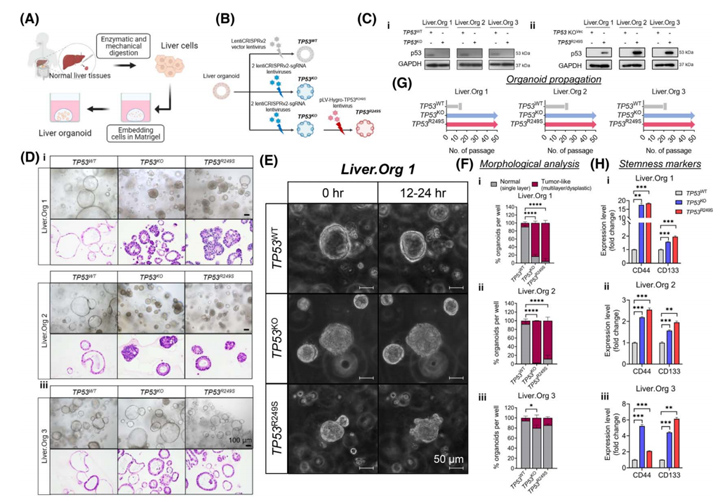
图2
3、突变肝类器官TP53R249S位点诱发肿瘤模型
为进一步探究R249S突变和癌症相关应激反应在肝癌发生发展中的作用,基因编辑构建TP53R249S类器官中R249S显性靶点显著上调(图3A),同时TP53KO中LOF靶点显著减少,这与原发性HCC中发现的表达一致。
通过双荧光素酶实验进一步确定了R249S突变体的直接转录效应:与对照组相比,在表达TP53R249S的细胞中,两个与应激反应相关的R249S显性靶点CLTC和PSMF1的启动子活性明显升高(图3B);同时与TP53R249S类器官相比,TP53KO类器官中存在大量紧凑的球状体,而TP53 WT类器官中只有微小的零星球状体(图3C)。TP53缺失的异种移植模型(ODXs)显示与TP53WT(0%)、TP53KO(17%)相比,TP53R249S(37%)的病变形成增加(图3D);组织学检查显示这些病变表现为腺状形成的不典型细胞,核多形性高色,偶尔胞浆空泡化,核仁突出的恶性特征(图3E)。
这些结果表明TP53R249S具有一定的致瘤潜能。更重要的是,突变体R249S直接转录激活PSMF1可以增加类器官对内质网应激的抗性,而下调PSMF1很容易消除这一点(图3F-I)。
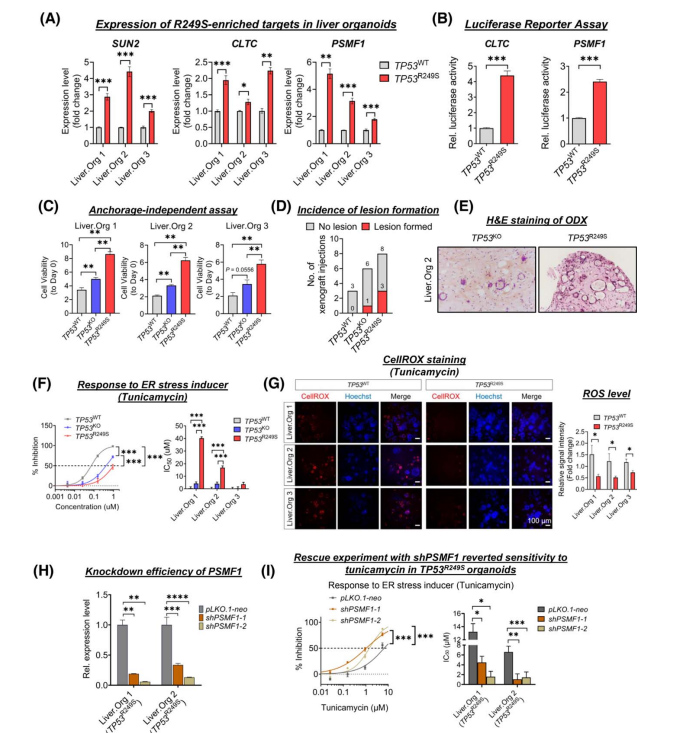
图3
4、通过染色质重塑靶向TP53R249S的治疗窗口
考虑到GO分析中R249S突变与“染色质重塑”密切相关,研究人员首先确认了TP53R249S肝类器官中R249S突变(BPTF、BRPF1和SMARCD2)显著上调(图4A)。体外模型中TP53R249S肝类器官更容易受到硫鸟嘌呤(一种抑制DNA合成和甲基化的表观遗传药物)的影响,显半抑制浓度值的敏感性显著提高4.5-7倍(图4B)。
接着,研究人员建立了TP53R249S肝类器官的ODX体内模型,一旦肿瘤体积达到约50 mm3,小鼠将连续14天随机使用硫鸟嘌呤(1.5 mg/kg)。结果显示,与对照组相比,TP53R249SODXs对硫鸟嘌呤更敏感,治疗14天后肿瘤体积明显缩小(图4C-D),而两组治疗组之间的体重没有显著差异(图4E);所有主要器官的组织学表现正常,表明硫鸟嘌呤的几乎没有副作用(图4F)。这些结果表明硫鸟嘌呤在体外和体内均具有靶向TP53R249S相关的GOF脆弱性的HCC治疗潜力。
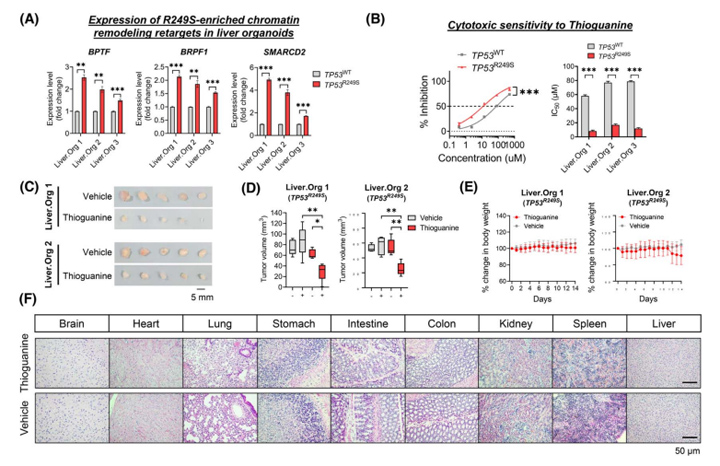
图4
作为斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展科研服务CRO、智慧实验室建设和精准医疗三大业务。目前,环特类器官平台已建立肝癌、胰腺癌、胃肠癌等多种肿瘤类器官模型,并推出免疫疗法治疗抗肿瘤药物的敏感性检测服务,欢迎来电垂询!
参考文献
[1] Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021;71:209–49.
[2] Schulze K, Imbeaud S, Letouze E, Alexandrov LB, Calderaro J, Rebouissou S, et al. Exome sequencing of hepatocellular carcinomas identifies new mutational signatures and potential therapeutic targets. Nat Genet. 2015;47:505–11.
[3] Ghosh M, Saha S, Bettke J, Nagar R, Parrales A, Iwakuma T, et al. Mutant p53 suppresses innate immune signaling to promote tumorigenesis. Cancer Cell. 2021;39:494–508.e5.
[4] Morrison CD, Chang JC, Keri RA, Schiemann WP. Mutant p53 dictates the oncogenic activity of c-Abl in triple‐negative breast cancers. Cell Death Dis. 2017;8:9–e2899.
[5] Dong P, Karaayvaz M, Jia N, Kaneuchi M, Hamada J, Watari H, et al. Mutant p53 gain-of-function induces epithelial– mesenchymal transition through modulation of the miR-130b-ZEB1 axis. Oncogene. 2012;32:3286–95.
[6] Monteith JA, Mellert H, Sammons MA, Kuswanto LA, Sykes SM, Resnick-Silverman L, et al. A rare DNA contact mutation in cancer confers p53 gain‐of‐function and tumor cell survival via TNFAIP8 induction. Mol Oncol. 2016;10:1207–20.
[7] Lee MK, Teoh WW, Phang BH, Tong WM, Wang ZQ, Sabapathy K. Cell-type, dose, and mutation type specificity dictate mutant p53 functions in vivo. Cancer Cell. 2012;22:751–64.
[8] Xu J, Reumers J, Couceiro JR, De Smet F, Gallardo R, Rudyak S, et al. Gain of function of mutant p53 by coaggregation with multiple tumor suppressors. Nat Chem Biol. 2011;7:285–95.
[9] Rahnamoun H, Lu H, Duttke SH, Benner C, Glass CK, Lauberth SM. Mutant p53 shapes the enhancer landscape of cancer cells in response to chronic immune signaling. Nat Commun. 2017;8: 1–14.
[10] Zhu J, Sammons MA, Donahue G, Dou Z, Vedadi M, Getlik M, et al. Gain-of-function p53 mutants co-opt chromatin pathways to drive cancer growth. Nature. 2015;525:206–11.
[11] Escobar‐Hoyos LF, Penson A, Kannan R, Cho H, Pan CH, Singh RK, et al. Altered RNA splicing by mutant p53 activates oncogenic RAS signaling in pancreatic cancer. Cancer Cell. 2020;38:198–211.e8.