
NEWS
新闻中心
SERVERS
服务项目
发布时间:2021-02-22
核心摘要
与成人癌症相比,小儿癌症很罕见。因此,许多儿科肿瘤都没有相关的基于细胞系或动物的模型来定义疾病发病机理或测试潜在的治疗方法。临床前药物研究一般来说需要用昂贵且耗时的啮齿动物模型来评估新疗法的疗效,并且由于财务方面收益有限,较小众的儿科癌症领域通常激不起业界开发新疗法的兴趣。
然而,小儿肿瘤已成为儿童和青少年死亡的主要原因。要改进小儿肿瘤的治疗,包括减轻长期治疗的副作用,需要对驱动这些肿瘤的遗传、表观遗传和发育因素有更深入的了解。在这里,我们回顾了斑马鱼模型在胚胎学、成像和识别肿瘤发生,进展和复发的新机制,以及新药发现方面的独特属性。我们聚焦于白血病、神经瘤和肉瘤的斑马鱼模型,这些疾病是常见和难治疗的儿童期癌症。
文丨Mattie J. Casey and Rodney A. Stewart
翻译丨朱家乐
发表于《Trends in Cancer》May 2020, Vol. 6, No. 5

一、综述
儿童肿瘤是儿童和青少年(0-19岁)死亡的主要原因之一,主要由白血病、神经系统癌症和肉瘤组成。更好地了解这组疾病的病因而进行的基因组谱分析工作已使基于分子特征的肿瘤类型分层成为可能,并鉴定了潜在的遗传驱动因素和协同分子事件,这些是不同儿科肿瘤发展的基础。
大多数小儿恶性肿瘤突变是细微的,被认为是由单一驱动基因,融合癌蛋白或结构/拷贝数改变驱动的。相反,成人肿瘤经常表现出较高的突变负担,这可能是因为在长期选择性压力下获得突变。
尽管存在这些差异,但是,小儿肿瘤的治疗仍然主要参照针对成人疾病设计的治疗方案,在给儿童治疗时可能导致会其虚弱,有长期副作用的情况。 为设计出更精确、更有针对性的治疗方法,以改善儿童肿瘤患者的预后,开发能够精准复现这些疾病的稳定的临床前儿科癌症模型是有必要的。在这里,我们讨论了斑马鱼作为一个临床前模型如何在儿科肿瘤领域推进基因和药物发现。
二、斑马鱼在癌症研究中的应用
斑马鱼因其独特地适用于遗传学,胚胎学和影像学的发展,发现了控制胚胎发生,神经发生和器官形成的新机制而作为一个发育生物学模型被建立。这些特征也使斑马鱼成为研究癌症的有吸引力的模型,因为:
(i)透明的斑马鱼胚胎和成鱼可以直接观察体内肿瘤细胞的行为;
(ii)斑马鱼的快速繁殖为遗传和药物筛选提供了广阔的平台;
(iii)鱼类和人类之间肿瘤信号通路的显著保守性使得发现肿瘤发生的新分子机制成为可能。
超过50种人类癌症的转基因斑马鱼模型已被建立,它们在组织和/或基因水平上都与人类相近。斑马鱼癌症模型加速了驱动人类癌症的新机制,以及可用于临床试验的新药物的发现。一些综述详细介绍了不同白血病、肉瘤、神经母细胞瘤和生殖细胞肿瘤模型建立的实验方法,并在其他地方发表。这里,我们聚焦于针对儿童和青少年肿瘤设计的转基因斑马鱼(我们定义为在生命的前90天出现肿瘤的斑马鱼)如何为儿科肿瘤的研究和治疗提供了依据。
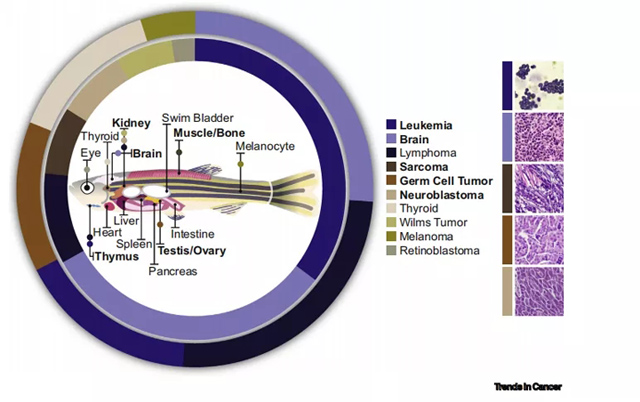
三、斑马鱼模型在白血病研究中的应用
急性淋巴细胞白血病(ALL)起源于骨髓中的T淋巴细胞和B淋巴细胞,是儿童常见的癌症。目前,通过包含化疗的典型治疗和高危或复发病例的异基因骨髓移植治疗,这些儿童的5年生存率超过90%。虽然这些患者的存活率很高,但目前的治疗有许多长期的有害副作用。由于这些原因,目前的工作重点是降低治疗毒性,并为高风险患者和复发疾病患者开发有针对性的治疗方法。
1、急性T淋巴细胞白血病:
急性T淋巴细胞白血病(T-ALL)占儿童急性淋巴细胞白血病的15%。T-ALL 在胸腺形成,来源于已经获得遗传或表观遗传变化并迁移到骨髓、外周血和淋巴结的未成熟胸腺细胞。
T-ALL患者的基因改变包括易位、基因融合、染色体获得和缺失以及表观遗传异常。儿童和成年T-ALL患者均在NOTCH,PI3K–AKT,JAK–STAT和RAS通路中表现出频繁的突变,不像大多数其他儿科癌症在突变上与成人癌症明显不同。早期的斑马鱼T-ALL模型总结了小鼠和人类研究,并快速的发现了此疾病的肿瘤进展与存活的新机制。
2、Myc驱动的T-ALL斑马鱼模型:
转基因斑马鱼肿瘤模型是应用rag2启动子驱动小鼠原癌基因Myc在T和B淋巴细胞中的表达的T-ALL模型。在Tg(rag2:mMyc)转基因模型中,Myc嵌合体表达诱导6%的动物出现T-ALL,平均潜伏期为44天。
由Myc驱动的T-ALL条件种系斑马鱼模型现已通过以下三种方法之一建立:
(i)将Cre mRNA注射到Tg(rag2-lox-dsRED-lox-EGFP-mMyc)斑马鱼胚胎;
(ii)让Tg(rag2:LDL-EGFP-mMyc) 和Tg(hsp70:Cre) 品系斑马鱼杂交;
(iii)用4-羟基他莫昔芬处理Tg(rag2:hMYC-ER)品系斑马鱼。
正如后面详述的,在这些精准模型中重现性和肿瘤分生率的提升(到生命第35天,肿瘤发生率达80%-100%),使得促进或抑制Myc-驱动T-ALL发病,发展和生存的新基因和/或遗传途径,以及可抑制体内肿瘤发生的药物的发现成为可能。
3、Notch驱动的T-ALL斑马鱼模型:
在超过60%的T-ALL病例中,NOTCH信号通路被异常激活,并能通过MYC依赖和非依赖通路促进T-ALL肿瘤的发生。
此外,NOTCH1和Myc在斑马鱼T-ALL发病过程中协同工作,因为与单独Myc或NICD的表达相比,rag2介导的Myc和NOTCH1的组成型活性细胞内结构域(NICD)的表达加快了T-ALL的进程。
增强的Notch信号传导不会增加白血病增殖细胞的数量,这表明NOTCH控制着癌前细胞的扩增,而Myc主要驱动克隆细胞的生长和存活。在约16%的复发性儿科T-ALL病例中,Notch通路突变也与Hedgehog通路的激活有关。ptch1(Hedgehog信号通路的负调节因子)的丢失加速了斑马鱼中notch1诱导的T-ALL的发作,这表明Hedgehog信号通路的激活与NOTCH1协同驱动T细胞转化。
4、确定T-ALL肿瘤发生的新遗传机制:
斑马鱼已被用于发现通过不同机制驱动T-ALL发病机理的新致癌辅因子。例如,发现胸腺选择HMG蛋白(TOX)与Myc以及NICD协同作用,通过受损的非同源末端连接DNA修复诱导基因组不稳定,从而促进斑马鱼的T-ALL进展。
ARID家族基因的表达升高会导致T-ALL肿瘤的myc水平升高,这表明ARID5B有助于T-ALL肿瘤发生过程中Myc的过表达。JDP2编码bZIP蛋白,其异常的淋巴细胞特异性表达与小儿T-ALL病例的整体生存期差有关,足以诱发超过50%的斑马鱼在受精后40周(wpf)患上T-ALL,并且与Myc共表达时能引起更高的肿瘤风险。因此,这些研究揭示了有可能靶向地使MYC驱动的T-ALL肿瘤失效的新机制的存在。
5、使用斑马鱼确定T-ALL的新疗法:
小儿白血病患者有>90%的存活机率。然而,当前的治疗方案会引起全身毒性,并且一部分患者会复发。
为了确定可能解决该问题的新型T-ALL治疗方法,使用T-ALL模型Tg(rag2:MYC-ER)品系斑马鱼对4880种FDA批准的化合物进行了小分子筛选。
斑马鱼胚胎实验发现,吩噻嗪类抗精神病药奋乃静可降低胸腺荧光,减轻MYC诱导的T-ALL斑马鱼的肿瘤总负荷,以及抑制鼠异种移植模型中人T-ALL细胞的生长。
在Myc; Akt驱动的T-ALL中,糖皮质激素地塞米松和AKT抑制剂(MK2206)的组合对抑制白血病增殖细胞非常有效。使用连续移植的方式,发现MK2206克服了地塞米松的耐药性,这一发现在人T-ALL细胞中得到了重现。MK2206进入了儿童难治性恶性肿瘤的I期临床试验,并且在测试剂量下耐受性良好,但迄今为止仅观察到有限的获益。
在斑马鱼Myc驱动的T-ALL模型中,发现jdp2的表达赋予地塞米松耐药性。斑马鱼数据表明,对AKT途径活化和/或JDP2升高的患者分层可能有助于预测对涉及糖皮质激素治疗的反应。
6、急性B淋巴细胞白血病(B-ALL):
B-ALL占所有儿童期ALL病例的85%。B-ALL和T-ALL在形态上是无法区分的,两种疾病的特征在于拥有不同的分子亚型。
尽管频率不同,成人和小儿B-ALL均存在相似的遗传和染色体异常,包括BCR-ABL1和ETV6-RUNX等融合基因,MLL重排,超倍性和亚倍性。
斑马鱼中的B-ALL模型使用非洲爪蟾伸长因子1α和斑马鱼β-肌动蛋白启动子普遍表达TEL-AML1(ETV6-RUNX),以诱导3%的B-ALL肿瘤发生率。
此外发现,Tg(rag2:hMYC)品系的一部分斑马鱼也患有B-ALL肿瘤,具有与T-ALL肿瘤不同的基因表达谱,表明该转基因品系实际上是混合型急性淋巴细胞白血病模型。这些研究强调需要结合现代比较肿瘤基因组学方法来验证正在建模的斑马鱼品系对应的人类肿瘤的确切类型和/或亚型。
7、急性髓系白血病(AML)斑马鱼模型:
AML的定义是,未成熟的骨髓细胞占据患者至少20%的骨髓。AML的整体5年生存率是64%,但不同分子亚型的患者,其生存率差异显著。
与其他恶性液体肿瘤不同,一些儿童AML患者的体细胞变异与成人AML中观察到的显著不同。儿童AML以AML1-ETO(也称为RUNX1-RUNX1T1),NUP98-NSD1和KMT2A-MLLT3等基因融合事件为唯一特征。
hsp70启动子驱动的AML1-ETO的表达,CMV启动子驱动的FLT3-ITD或FLT3-TKD的表达,导致早期斑马鱼胚胎中的髓样细胞扩增。使用COX2抑制剂尼美舒利阻止β-连环蛋白介导的骨髓生成,可以逆转AML1-ETO胚胎的造血缺陷。
此外,通过使用酪氨酸激酶抑制剂(AC220)可以消除FLT3-ITD动物的髓样扩增,而FLT3-TKD动物则不能,这表明看似相似的遗传异常存在不同的治疗机率。这些研究说明了斑马鱼胚胎在了解造血过程中致癌融合基因的基本机制以及发现小儿白血病新疗法方面的实用性。
四、斑马鱼模型在脑和中枢神经系统肿瘤研究中的应用
脑和中枢神经系统肿瘤是小儿癌症相关死亡的主要原因。大约75%的小儿脑肿瘤是恶性的,其5年总生存率达78%。
此外,肿瘤的外科手术减瘤,放疗和常规化疗会给发育中的大脑带来长期并发症。幸运的是,小儿脑肿瘤的基因组表征方面的重大进展已经确定了具有不同分子谱的特定脑肿瘤,从而可以对具有复发性基因组特征的肿瘤进行更准确的分类。而现在的挑战是为基因和药物发现开发基于细胞和动物的新的脑肿瘤模型。
1、中枢神经系统原始神经外胚层肿瘤(PNETs)的模型:
CNS-PNETs通常出现在大脑中,占小儿脑肿瘤的3–5%。CNS-PNET的一个亚群称为CNS NB-FOXR2,它表达对少突胶质前体细胞(OPC)和RAS / MAPK途径活化至关重要的转录因子。
为了对此亚组进行建模,我们在表达sox10的OPC中激活了NRAS信号传导,该信号以6 wpf的频率启动了脑肿瘤的形成,表明OPC是这些肿瘤的起源细胞,而且可以通过激活的RAS / MAPK信号传导进行转化。
组织学和跨物种的基因组分析表明,与任何其他CNS-PNET亚型甚至正常的斑马鱼脑相比,斑马鱼脑肿瘤与人CNS NB-FOXR2肿瘤的相似性更高令人惊讶的是,斑马鱼CNS NB-FOXR2肿瘤对MEK抑制剂(AZD6244)的治疗选择性敏感,表现为肿瘤负荷显著减少,总生存期增加。AZD6244目前正处于治疗小儿脑肿瘤的临床试验中,可以有效地用于治疗CNS NB-FOXR2患者。
这些研究表明,斑马鱼能如何被用于快速测试细胞遗传学起源和通路激活预测,这些预测源于目前针对小儿脑肿瘤实体(包括罕见亚组)靶向疗法开发的新基因组数据。
斑马鱼似乎是用于检测OPC衍生的儿科肿瘤的遗传驱动力的优秀动物模型。例如,斑马鱼中nfla / b或rb 1肿瘤抑制基因的丢失(通常为p53缺陷)会产生类似于少突胶质细胞瘤的脑肿瘤或类似于CNS-PNETs的胚胎肿瘤。
这些研究表明,OPC衍生的儿科肿瘤获得遗传或表观遗传学变化,终导致E2F转录因子家族激活,并且提示此类肿瘤对E2F抑制剂(例如HLM006474)敏感,而不考虑当初的致癌驱动因素。
2、神经母细胞瘤(NB):
NB是一种起源于神经衍生的周围交感神经系统的实体瘤。它是婴儿中常见的非颅骨实体瘤,好发于肾上腺。NB患者的治疗方法通常包括手术切除、化疗、放疗和骨髓移植。
目前,更好地了解高危NB的潜在机制很有必要,因为这些患者的5年生存率仅为50%。斑马鱼系统对于发现新的致癌驱动因素,联合基因突变和促进高风险NB的发育转录网络以及新的治疗模式具有极其重要的价值。
3、神经母细胞瘤的斑马鱼模型:
在约20%的NB患者中观察到MYCN基因的扩增,其与预后不良有关。NB的斑马鱼模型是通过使用多巴胺-β-羟化酶(dβh)启动子将人MYCN基因靶向表达到发育中的周围交感神经系统来驱动的。低(17%)和高(70%)风险的NB斑马鱼模型已建立,以分别用于检测可增加或减少肿瘤负荷的协同突变。低风险NB模型Tg(dβh:EGFP-MYCN)表达EGFP-MYCN融合蛋白,而高风险Tg(dβh:EGFP;dβh:MYCN)模型涉及EGFP和MYCN基因的共整合而不是融合。在这两种模型中,斑马鱼NB肿瘤在组织学上都与人NB类似,并且主要在肾间腺(斑马鱼与人肾上腺髓质等同的部位)中出现。
低风险Tg(dAh:EGFP-MYC)NB模型已用于鉴定与MYCN协同促进NB肿瘤发生的许多基因。例如,MYCN扩增的患者经常存在RAS信号通路的修饰,包括ALK,NF1和PTPN11的突变。MYCN与ALKF1174L,PTPN11E69K的共表达或nf1的缺失减少了肿瘤发作的潜伏期并增加了得肿瘤的风险。这些研究表明,RAS通路的激活是引起体内发生侵袭性NB的重要事件,并且RAS通路抑制剂可能能够有效减缓或预防MYCN扩增的NB的疾病进展。重要的是,目前正在评估ALK抑制剂在高危NB中的临床疗效。
高风险的NB患者经常表现出较广泛的基因组重排,包括染色体的获得和缺失。因此,斑马鱼NB模型已用于筛选存在于染色体失衡区域的潜在恶性肿瘤相关基因。在斑马鱼NB模型Tg(dβh:EGFP-MYCN)品系中,测试了代表了高危NB病例中典型的染色体获得的位于1q号染色体上的候选基因能否改变肿瘤发生的风险,并且消化器官扩增的能力因子(DEF)基因被鉴定为NB在体内的协同驱动子。
此外,def单倍剂量不足可通过诱导细胞凋亡显著降低高风险Tg(dβh:EGFP;dβh:MYCN)品系以及人NB细胞系中的肿瘤生长。因此,DEF可能成为具有1q染色体获得的NB患者新的治疗靶点。
大约50%的高危NB病例没有MYCN扩增,因此其他遗传或流行病事件可能导致了这些高度恶性的癌症。例如,近的一项研究表明,MYMY的同系物cMYC可以诱导斑马鱼的侵袭性NB。这是提供人类细胞和患者样本数据的动物模型,该模型显示10%的不依赖MYCN的高风险NBs通过8q24易位的远距离增强子或增强子劫持而引起cMYC mRNA和蛋白水平异常表达。因此,现在可以根据MYCN与cMYC蛋白的表达对高危NB患者进行分层,以终实现精准医疗。
NB的一项重大临床挑战是转移的治疗,这在NB诊断时经常出现。全基因组关联研究确定LIM-only结构域基因(LMO1)与高度转移性NB肿瘤密切相关。LMO1与MYCN的共表达仅轻微改变肿瘤风险和发病,但会显著增加NB转移的发生。LMO1的过表达还增强了人NB细胞的迁移能力,并上调了参与细胞外基质重塑的基因。这些研究为快速发现能影响体内NB转移的其他遗传事件和/或药物铺平了道路。
五、斑马鱼模型在肉瘤研究中的应用
软组织和骨肉瘤占所有儿童期癌症的7%。儿童和青少年中常见的肉瘤是横纹肌肉瘤(RMS)。
它由未分化的肌肉细胞形成,通常出现在头/颈部,泌尿生殖道或四肢。横纹肌肉瘤有两种主要的组织学亚型,胚胎型(ERMS)和肺泡型(ARMS)。
ERMS占所有RMS病例的75%,通常特征在于11p15.5位点或MYOD1,FGFR4以及编码主要RAS GTPases的任何基因的点突变处的11p15.5基因座杂合性丧失。
相比之下,80%的ARMS患者表现出PAX3-FOXO1或PAX7-FOXO1融合基因的过表达。在过去的50年中,RMS治疗在很大程度上保持不变,仅限于局部切除,放射治疗和多药化疗,尽管二代测序和患者分子分型取得了进展,但ERMS患者的5年生存率保持在82%,ARMS患者保持在65%。如稍后所述,斑马鱼RMS模型为我们对这些小儿癌症的病因学的理解做出了重要贡献。
1、融合阴性RMS的斑马鱼模型:
斑马鱼ERMS研究模型是使用rag2启动子驱动组成型活性KRAS(KRASG120)基因的表达而建立的。在该模型中,KRASG120以散在的形式在肌卫星细胞中异常表达(因为非淋巴细胞中rag2启动子片段的异常激活)。这些鱼中近50%会迅速(受精后10-80天)发展出肿瘤。使用人类RMS的临床标记物的RNA原位杂交以及基因集富集分析研究证实,斑马鱼肿瘤的基因组与人类ERMS极为相似。这些研究表明,肌卫星细胞至少是ERMS起源细胞之一。
肿瘤复发是有效治疗ERMS的重大临床挑战。斑马鱼ERMS模型已被用于识别在ERMS发病过程中可能影响肿瘤繁殖细胞(TPC)行为的潜在基因。Tg(rag2:KRASG12D)斑马鱼ERMS驱动因子与先前确定的对肌肉再生和干细胞自我更新很关键的基因共表达,包括rag2-ICN1(斑马鱼胞内激活的NOTCH1),rag2-Vangl2或mylpfa-myf5。重要的是,控制ERMS中TPC的遗传机制在小鼠RMS异种移植的人类细胞以及体外成球试验中均是保守的。因此,ERMS的斑马鱼模型在发现新的,保守的肿瘤复发和ERMS自我更新机制中发挥了作用,现在可以在临床前试验中探索这种机制,以改善患有复发或转移性疾病的儿童的生存率。
斑马鱼Tg(rag2:KRASG120)模型已用作临床前模型,用于测试在ERMS肿瘤生长过程中抑制KRAS信号传导的药物的功效。下游KRAS效应物(如MEK(PD98059)和S6K1(TPCK))的协同药理失活作用,表明对MAPK和AKT途径的双重抑制可能是KRAS驱动的ERMS的有效靶向疗法。
此外,在斑马鱼和人类RMS细胞中,抑制RAS和mTOR通路均会抑制翻译起始,为有生长抑制作用的药物在ERMS中应用提供了机制基础。相似的研究发现,VEGFA抑制剂(西地尼布)可将ERMS肿瘤的生长降低三倍,并降低微血管的密度,这表明VEGFA信号可能通过促血管生成促进ERMS肿瘤的进展。
此外,GSK3(6-溴吲哚宾-3'-肟)和HDAC(曲古抑菌素A或伏立诺他)的抑制剂可阻止ERMS肿瘤的生长。重要的是,所有这些研究都利用了基于人类RMS细胞的模型来揭示药物对细胞生长/增殖,分化和迁移的影响,从而为这些药物的临床疗效突显提供可能性。
2、融合阳性RMS的斑马鱼模型:
近期,通过使用CMV启动子普遍表达人PAX3-FOXO1融合基因的方式建立了一个新的斑马鱼ARMS模型。
与ERMS模型相比,ARMS的起源是未知的。尽管如此,这些研究表明,PAX3-FOXO1人融合癌基因足以将斑马鱼细胞转化为具有独特组织学特征的ARMS肿瘤或CNS-PNETs。PAX3–FOXO1导致转录因子hes3在肌肉细胞中异常表达,从而阻断了肌肉分化标志物的表达。
同样地,人HES3在斑马鱼和肌肉祖细胞中的表达抑制肌生成,而人RMS患者中HES3的表达增加会导致预后不良。因此,这种斑马鱼模型为保守的遗传机制研究(PAX3–FOXO1融合基因介导肿瘤发生)提供了重要的见解。实际上,融合阳性肉瘤研究的一项重要进展是能够使用斑马鱼模型在无需事先了解起源细胞的情况下,快速检测融合癌蛋白的转化潜力。
六、结论
与成人癌症相比,小儿癌症很罕见。因此,许多儿科肿瘤都没有相关的基于细胞系或动物的模型来定义疾病发病机理或测试潜在的治疗方法。临床前药物研究一般来说需要用昂贵且耗时的啮齿动物模型来评估新疗法的疗效,并且由于财务方面收益有限,较小众的儿科癌症领域通常激不起业界开发新疗法的兴趣。
因此,我们认为,斑马鱼模型对小儿癌症研究的关键的好处是能够以及时且负担得起的方式开发稀有肿瘤亚型模型(如先前针对白血病、脑瘤、NB和肉瘤的描述)以进行临床前药物发现。
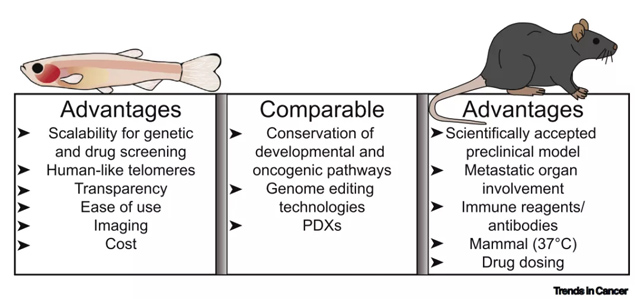
此外,斑马鱼独特的成像属性是一个强大的工具,可以直接监测侵袭和转移过程中肿瘤细胞的行为以及对药物治疗的反应。这些属性对于研究成人癌症同样重要,并且已在其他地方进行了评论。这些特征以及斑马鱼和鼠模型在儿科肿瘤研究中的不同优势的比较如图2所示。
斑马鱼儿科肿瘤模型仍然需要解决许多悬而未决的挑战。使用特定的启动子元件或CRISPR / Cas9介导的敲入等位基因完善一些现有的斑马鱼模型,有望大大推动该领域的发展。借助癌基因组分析和细胞起源特异性启动子的使用,还可以在斑马鱼中建立主要类别的小儿肿瘤新模型,包括髓母细胞瘤,视网膜母细胞瘤,Wilms肿瘤,甲状腺癌和癌症易感综合症(Box1)。
此外,斑马鱼患者异种移植(PDX)模型(Box2)有望加速新疗法的鉴定。因此,斑马鱼儿科肿瘤研究领域有望满足目前对儿童癌症的许多需求,尤其是在使用基于精确医学的方法治疗罕见肿瘤方面的应用。
Box 1. 肿瘤易感综合征:
大约10%的儿童和青少年癌症是由癌症易感基因(例如P53,NF1,RB1和APC)的突变引起的。常见的癌症易感性疾病包括神经纤维瘤病、Noonan综合征、Costello综合征、视网膜母细胞瘤、Down综合征、Gorlin综合征和Li-Fraumeni综合征。
一些突变引起特定类型的肿瘤(例如RB1突变和成视网膜细胞瘤),而另一些则使患者易患多种不同的癌症类型(例如与Li-Fraumeni综合征相关的P53突变)。癌症易感综合症通常与多种癌症的诊断,典型的成人特异性癌症的儿童期发作,先天性异常并发以及某些肿瘤的发展有关。
然而,从认识驱动突变因子到获得诊断疾病的能力,我们对癌症发展过程中小儿癌症易感性综合征的发生机制的理解上仍然存在相当大的差距。先前使用Tol2介导的基因陷阱引入组合型活性HRASV12-GFP来在斑马鱼中模拟Costello综合征的工作促进了与Costello综合征相关的一些特征的发展,例如体长较短,颅面缺陷者以及有RMS倾向(尽管概率很低)。
此外,还开发了带有p53缺失突变体的Li-Fraumeni综合征模型,该突变体自发地发展为血管肉瘤,生殖细胞肿瘤,白血病和恶性周围神经鞘瘤。然而,该领域需等待其他基因组学研究和针对其他癌症易位综合征的其他动物模型的开发,然后才能朝着发现有效治疗方案的方向进一步发展。
Box 2. 小儿癌移植模型:
PDX模型是评估新的抗癌疗法和通过移植原发性患者肿瘤联合精准医疗的重要工具。对于这些研究而言,通常免疫缺陷小鼠需要植入移植物2–8个月才能开始评估治疗方案。
斑马鱼的幼鱼也被用于建立肿瘤异种移植模型,因为其免疫系统要到4周龄才能完全成熟。斑马鱼胚胎和幼鱼移植能够在短短的10天之内进行高通量药物筛选并直接肿瘤细胞的行为是可视化的。
但是,幼鱼生长所需的适应性免疫系统和较低的温度(28–35℃)会杀死人类细胞。该领域的一项令人振奋的进展是,建立了一种透明的prkdc-/-;il2rga-/-斑马鱼品系,该品系斑马鱼缺少T,B和自然杀伤细胞,且能在37℃生长,可以长期稳定地建立与免疫缺陷小鼠PDX模型有相同的肿瘤生长,增殖和存活动力学的人类PDX模型。由于该研究可以在28天内完成,因此可以进行实时治疗评估,这是精确医学目前尚不具备的重要功能。
然而,免疫功能低下的模型仍然不是理想的,因为许多癌症患者在治疗前保留了功能性免疫系统。然而,人源化PDX模型的开发(其中动物同时植入了人类造血干细胞和PDX),使得能够在部分免疫应答的情况下评估肿瘤动力学,并能够测试相关的抗癌免疫疗法的功效。通过将人类免疫祖细胞与患者肿瘤共移植并产生针对人类细胞生长而优化的转基因斑马鱼品系,包括人生长因子(例如IL-3和GM-CSF)的表达,这种迅速发展的领域有望在不久的将来在斑马鱼中成为可行。
参考资料:
[1] Cunningham, R. et al. (2018) The major causes of death in children and adolescents in the United States. N. Engl. J. Med. 379,2468–2475
[2] Grobner, S.N. et al. (2018) The landscape of genomic alterationsacross childhood cancers. Nature 555, 321–327
[3] Ma, X. et al. (2018) Pan-cancer genome and transcriptome analyses of 1,699 paediatric leukaemias and solid tumours. Nature555, 371–376