
NEWS
新闻中心
SERVERS
服务项目
发布时间:2021-10-21
精原干细胞(Spermatogonial stem cells,SSCs)是成体雄性性腺中具有自我更新和分化潜能的一类生殖干细胞。利用精原干细胞移植(Spermatogonial stem cell transplantation, SSCT)技术,有可能实现跨个体甚至是跨物种的“借腹生殖”,也就是利用个体(或物种)B产生个体(或物种)A的功能性配子。SSCT“借腹生殖”是研究配子发生和性腺发育的一项重要技术,同时其在快速、高效的定向育种中也具有广阔的应用前景。SSCT“借腹生殖”能否在遗传距离较大(如跨亚科及以上遗传距离)的不同物种间实现,是这一领域的经典难题。

近日,钱江特聘专家、中国科学院水生生物研究所孙永华课题组在Science China Life Sciences发表了题为”Surrogate production of genome edited sperm from adifferent subfamily by spermatogonial stem cell transplantation“的研究论文,利用鱼类SSCT首次实现了亚科物种间的“借腹生殖”,并成功获得了跨亚科物种来源的经基因编辑的SSCT精子。该项研究受到国家杰出青年科学基金、“发育编程及其代谢调节”国家重点研发计划、国家自然科学基金创新研究群体等科研项目的支持。
研究成果概述
在前期的研究中,孙永华课题组在斑马鱼中建立并优化了鱼类基因编辑配子的“借腹生殖”技术(J Genet Genomics,2020;Faculty of 1000推荐),快速而高效地获得了纯合突变致死基因的母源合子突变体,从而为斑马鱼母源基因的功能研究开辟了一条新的途径。
为进一步探究在鱼类异种间能否建立基因编辑配子的“借腹生殖”技术,该团队选择了跨亚科的两个鱼类物种——稀有鮈鲫和斑马鱼——作为SSCT供体和受体,将生殖细胞靶向的CRISPR/Cas9基因编辑和SSCT“借腹生殖”技术进行有机整合和优化,成功利用受体斑马鱼快速、高效地获得了供体稀有鮈鲫来源的经基因编辑的精子(图1)。

图1. 该研究技术路线图及稀有鮈鲫SSCs的分离及向斑马鱼幼鱼的移植
为追溯供体稀有鮈鲫SSCs在受体斑马鱼中的发育命运,研究者精细刻画了移植SSCs在斑马鱼性腺中定植、增殖、分化的全过程,并通过组学和实验生物学手段证实了SSCT精巢是由供体稀有鮈鲫生殖细胞和受体斑马鱼性腺体细胞所构成的嵌合性腺(图2)。有趣的是,“借腹生殖”斑马鱼所产生的SSCT精子,虽然其核基因组完全来源于供体稀有鮈鲫且只能与稀有鮈鲫卵进行受精,但其形态学特征和游动行为更接近于受体斑马鱼精子。
通过比较SSCT精子和普通稀有鮈鲫精子的转录组,研究者发现斑马鱼性腺体细胞的一些转录产物可能通过某种方式被转运到了SSCT精子细胞中,从而影响了“借腹生殖”所产生的稀有鮈鲫精子的形态和行为特征。该研究也是首次利用“借腹生殖”技术产生异种来源的基因编辑配子,这为利用该技术定制未来养殖鱼类的配子奠定了坚实的理论和实验基础。
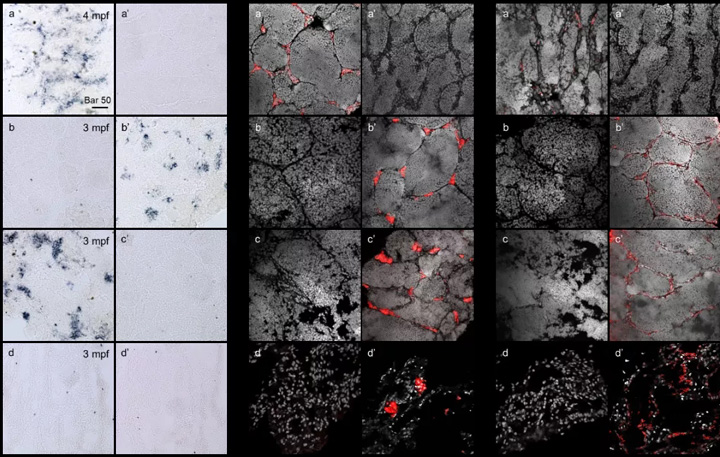
图2 SSCT精巢是由稀有鮈鲫(Gr)的生殖细胞和斑马鱼(Dr)的体细胞构成
附论文详细版
一、综述
精原干细胞(Spermatogonial stem cells,SSCs)是成体雄性性腺中具有自我更新和分化潜能的一类生殖干细胞。利用精原干细胞移植(Spermatogonial stem cell transplantation, SSCT)技术,有可能实现跨个体甚至是跨物种的“借腹生殖”,也就是利用个体(或物种)B产生个体(或物种)A的功能性配子。
在鱼类中,这项技术首先应用在斑马鱼——一种广泛使用的模式动物上,然后扩展到其他鱼类,如鲑鱼和虹鳟鱼 。在之前的实验中,不同类型的 GSC,例如 PGC、SSC 和卵源干细胞 (OSC),已被用作移植到其他物种的胚胎、幼虫或成虫中的供体。作为容易获得的 GSC 类型,SSC 已被广泛地用于移植。SSCT“借腹生殖”是研究配子发生和性腺发育的一项重要技术,同时其在快速、高效的定向育种中也具有广阔的应用前景。
生殖细胞靶向的CRISPR/Cas9基因编辑技术已被用于多种鱼类,以研究基因功能或潜在地改善水产养殖育种,并且已经产生了大量基因无效突变体,如斑马鱼。此外,如果我们打算生产体型较大的基因组编辑鱼,通常需要庞大且昂贵的设施来饲养和筛选个体。
近来,我们开发了一种方法,在斑马鱼中建立并优化了鱼类基因编辑配子的“借腹生殖”技术(J Genet Genomics,2020;Faculty of 1000推荐),通过结合 PGCs 靶向基因组编辑和 PGCs 移植 (PGCT) 技术,快速而高效地获得了纯合突变致死基因的母源合子突变体。然而,SSCT“借腹生殖”能否在遗传距离较大(如跨亚科及以上遗传距离)的不同物种间实现,是这一领域的经典难题。
稀有鮈鲫,隶属于鲤形目、鲤科、鮈鲫属,主要分布于长江上游大渡河支流和中国四川省的一些小河中。近年来,稀有鮈鲫由于栖息地破坏、外来鱼类的引入和过度捕捞,在野生环境中越来越少见,已被列为濒危物种。
近年来,稀有鮈鲫因其体型小、易于养殖、繁殖力强、胚胎透明、对鱼鳞病敏感等优良特性,已发展成为研究鱼类病理学、遗传学、环境科学、胚胎学和生理生态学的实验用鱼。通过结合 CRISPR/Cas9 和异种 SSCT 技术,这两种来自不同亚科的实验室鱼类,是探索替代生产进化遥远物种衍生的基因组编辑配子的可行性的理想选择。
在这里,为进一步探究在鱼类异种间能否建立基因编辑配子的“借腹生殖”技术,我们使用跨亚科的两个鱼类物种——稀有鮈鲫和斑马鱼——作为SSCT供体和受体,将生殖细胞靶向的CRISPR/Cas9基因编辑和SSCT“借腹生殖”技术进行有机整合和优化,成功利用受体斑马鱼快速、高效地获得了供体稀有鮈鲫来源的经基因编辑的精子, 明确了斑马鱼性腺中定殖、增殖和分化的动态过程。 有趣的是,“借腹生殖”斑马鱼所产生的SSCT精子,虽然其核基因组完全来源于供体稀有鮈鲫且只能与稀有鮈鲫卵进行受精,但其形态学特征和游动行为更接近于受体斑马鱼精子。
二、实验结果
1、供体稀有鮈鲫SSCs在受体斑马鱼中的定植、增殖、分化
为了更好地了解移植SSCs 在斑马鱼受体中的发育动态,我们分析了斑马鱼受体的定植、增殖和分化。 通过组学和实验生物学手段证实了SSCT精巢是由供体稀有鮈鲫生殖细胞和受体斑马鱼性腺体细胞所构成的嵌合性腺。
首先,在 3 wpt 时,通过使用供体细胞的红色荧光标记,我们观察到荧光供体细胞在游泳膀胱下方的受体性腺区域定植(图 4A, a),而在未经处理的对照幼虫中未观察到荧光(图 4一、二)。进一步的解剖和观察表明,许多荧光供体细胞定植在宿主斑马鱼的性腺中(图 4A, a'),而在未移植的对照性腺中未观察到荧光(图 4A, b')。根据不同的供体和受者,定植率从 25% 到 85% 不等。
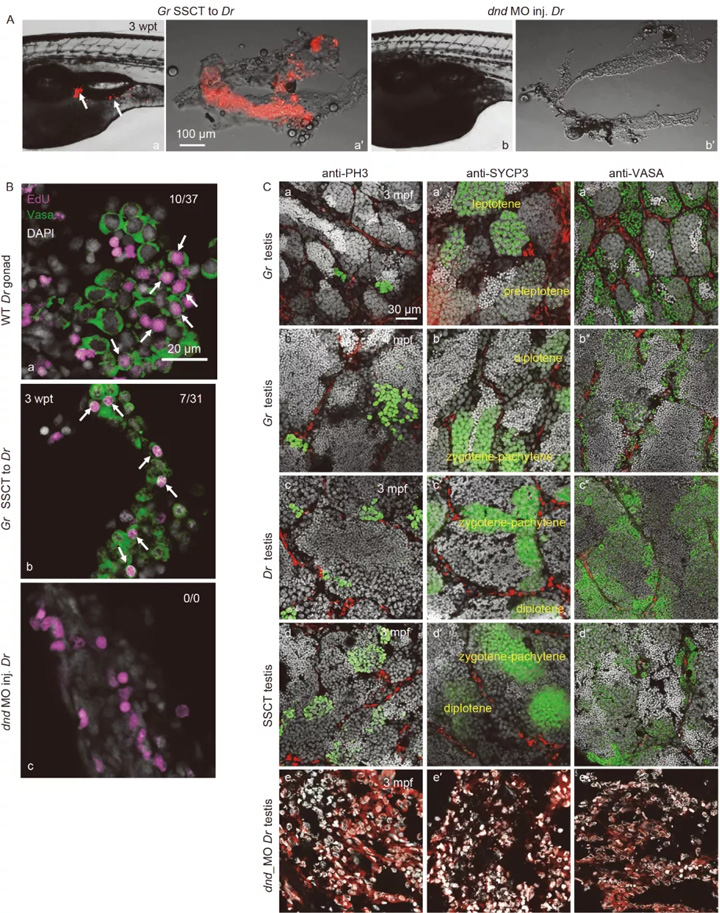
图4 定植、增殖和分化稀有鮈鲫 斑马鱼受体中的 SSC
为了研究供体 SSC 的增殖,我们进行了 EdU 检测,发现 SSC 定植的斑马鱼性腺中存在大量增殖性 VASA 阳性生殖细胞(图 4B, b), 只是模仿 WT 斑马鱼性腺中的那些 (图 4B, a),而未移植的对照性腺中没有增殖生殖细胞(图 4乙,丙)。
为了进一步表征 SSCT 移植鱼生殖细胞的增殖和分化,我们用有丝分裂标记 PH3 对精巢进行了免疫荧光染色。在发育的精巢中,SSCT阳性的精巢中有很多细胞在进行有丝分裂和减数分裂(图 4C, d–d'),模仿在稀有鮈鲫精巢(图 4C, a, b, a', b') 和斑马鱼成年精巢 (图 4C, c-c')。VASA 的免疫染色证实移植的稀有鮈鲫SSCs恢复了不育斑马鱼雄性的精子发生,在SSCT阳性精巢中观察到了包括精原细胞、精母细胞、精子细胞和精子在内的各种生殖细胞(图 4C, d''), 与 WT 中看到的一致稀有鮈鲫(图 4C, b'') 和斑马鱼精巢(图 4C, c'')。相比之下,在 3 mpf 时,稀有鮈鲫精巢仅含有大量精原细胞和精母细胞,只有少数精子细胞(图 4C, a, a', a'') 和大量的精母细胞在前细线期或细线期,表明减数分裂的开始(图 4C, a')。这些表明,稀有鮈鲫的生殖细胞可以有效地增殖和分化 斑马鱼宿主精巢,SSCT 精巢的成熟期与斑马鱼精巢相似。
2、替代精巢中不同性腺细胞的组成
为了进一步表征替代精巢中不同性腺细胞的组成,我们进行了 RNA针对生殖细胞物种特异性标记的杂交分析,以及两种类型的性腺体细胞。
有趣的是,在 SSCT 精巢中,只有稀有鮈鲫可以检测到生殖细胞,但不能检测到斑马鱼生殖细胞(图 5A, c-c'); 而 Leydig 细胞和 Sertoli 细胞均来自宿主斑马鱼(图 5B, c-c', C, c-c'),表明 SSCT 精巢是重建的性腺,包括稀有鮈鲫衍生的生殖细胞和斑马鱼衍生的性腺体细胞。
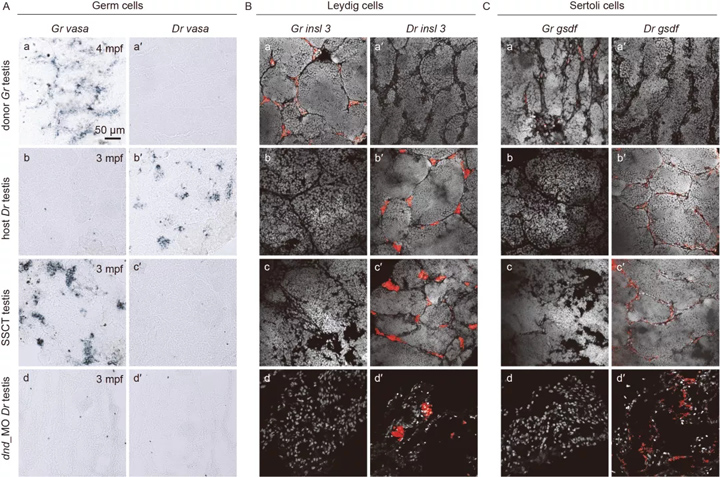
图5 SSCT 阳性精巢由供体来源的生殖细胞和受体来源的性腺体细胞组成
综上所述,我们发现稀有鮈鲫 SSCs不仅可以在斑马鱼受体体内定殖和增殖,还可以支持斑马鱼性腺体细胞的发育和功能,在重建的功能精巢中进行正常的精子发生并分化为精子。
3、来自 SSCT 的精子形态和游泳行为与宿主相似,但与供体不同
尽管 SSCT 阳性斑马鱼可以产生功能性稀有鮈鲫 精子,我们感兴趣的是来自替代斑马鱼的精子和来自替代斑马鱼的精子之间是否存在任何差异性。
通过扫描电子显微镜 (SEM) 分析,SSCT 精子的形态看起来更类似于斑马鱼精子而不是稀有鮈鲫精子,因为前两个具有突出的线粒体鞘结构(图 6A),他们拥有椭圆形的球头,而稀有鮈鲫 精子头部看起来更圆,没有典型的线粒体鞘(图 6A、a'、b'、c')。

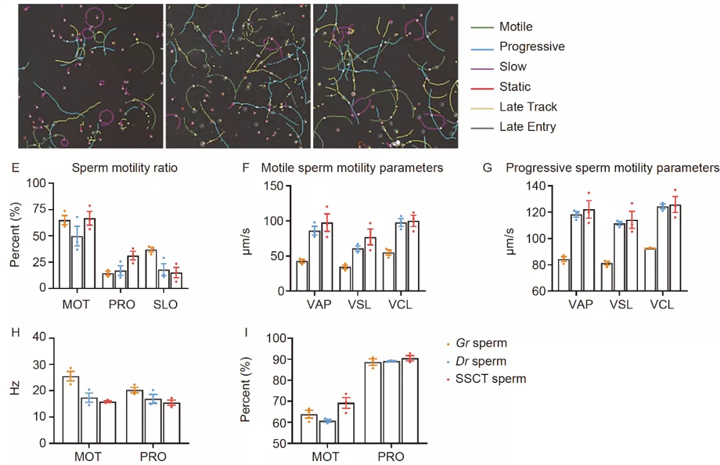
图6 来自 SSCT 阳性斑马鱼精子的形态和活性与宿主相似,但与供体不同
此外,SSCT 精子的平均头部直径(1.55 微米) 明显大于稀有鮈鲫 精子 (1.46 微米), 并且更接近斑马鱼精子 (1.65 微米) (图 6B)。SSCT精子平均尾长(30.32 微米) 几乎与斑马鱼精子相似 (30.80 微米), 但明显短于稀有鮈鲫 精子 (32.42 微米) (图 6C)。它们鞭毛的中心是具有典型“9×2+2”微管结构的轴向细丝(图S5A,支持信息中的a-c),尾巴直径在它们之间没有显着差异。
透射电子显微镜 (TEM) 分析表明,头部膜在稀有鮈鲫(图 S5A,a')和 SSCT 精子(图 S5A,c'),而斑马鱼精子则是平滑的(图 S5A,b')。斑马鱼精子在头前部具有明显的细胞质。统计表明,线粒体数量在稀有鮈鲫和 SSCT 精子,与斑马鱼精子相比(图 S5C)。
随后,游动时的稀有鮈鲫, 斑马鱼和 SSCT 精子被测量,并且 SSCT 精子的轨迹图类似于斑马鱼精子的轨迹图而不是稀有鮈鲫精子(图 6D)。
统计表明,“借腹生殖”斑马鱼所产生的SSCT精子,虽然其核基因组完全来源于供体稀有鮈鲫且只能与稀有鮈鲫卵进行受精,但其形态学特征和游动行为更接近于受体斑马鱼精子。
4、高效生产 pou5f3 和 chd-变异的稀有鮈鲫斑马鱼替代品中的精子
在之前的研究中,我们通过结合 CRISPR/Cas9 基因敲除技术和同种异体 PGCT 在斑马鱼中成功生成了供体来源的基因组编辑配子。
为了进一步验证SSCT“借腹生殖”能否在遗传距离较大(如跨亚科及以上遗传距离)的不同物种间实现,我们选择了对大脑和背部发育至关重要的两个基因——pou5f3和 慢性病 ,通过比较SSCT精子和稀有鮈鲫精子的转录组,SSCs 被纯化并用于异种 SSCT 进入斑马鱼替代物。研究验证了稀有鮈鲫通过 CRISPR/Cas9 靶向 SSCT 技术,可以在相对较短的成熟期内在斑马鱼宿主中有效地获得突变精子。
当移植的斑马鱼在 3 mpf 长到成年时,通过将它们与 WT 斑马鱼雌性一一交配来筛选出 SSCT 阳性个体。为了评估 SSCT 阳性雄性产生的精子的突变效率,分析了 SSCT 阳性雄性和斑马鱼雌性杂交的每个胚胎的靶序列。
令人惊讶的是,SSCT 精子的突变效率在10 个pou5f3-变异的稀有鮈鲫精子中都达到了 100%。此外,51.8%的后代表现出典型的表型,躯干缩短,尾巴异常。(图 7B, c) 表型分析表明,C1 胚胎在 30 hpf 时显示出正常的脑结构,包括顶盖(t)、小脑(c)、后脑(h)和耳板(o)(图 7B, b'),而在 C2 胚胎中,后脑是杂乱无章的(图 7B, c', 红色箭头),耳板缩小,仅包含一个耳石(图 7B,c',蓝色箭头)。α-微管蛋白染色进一步证实了 C2 胚胎在 2 dpf 时脑结构的紊乱(图 7C)。这些结果与在斑马鱼中的结果一致。
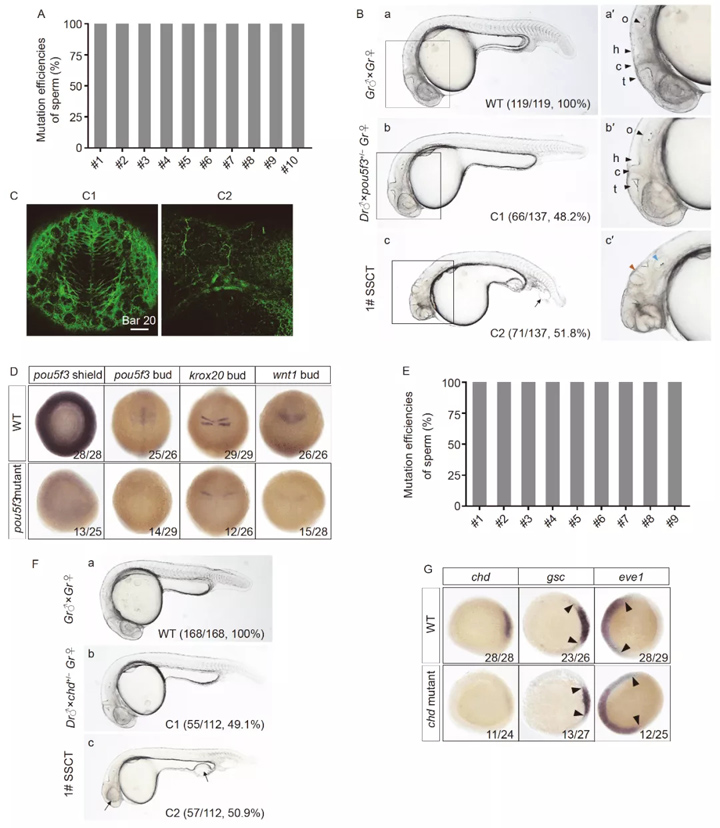
图7 高效生产基因组编辑稀有鮈鲫斑马鱼替代品中的精子
5、SSCT 精子与 稀有鮈鲫转录组的精子
为了揭示SSCT精子和稀有鮈鲫转录组的精子在分子水平上的差异,通过RNA-seq 进行分析发现,数量有限的 54 个 DEG中,47 个 DEG显著上调 ,上调的 DEG 主要代表 SSCT 精子中存在斑马鱼基因组衍生的转录本, 7 个 DEG显著下调。
令我们吃惊的是,47 DEG 中的大多数在 SSCT 精子样本中表现出极高的表达水平,表明斑马鱼性腺体细胞的一些转录产物可能通过某种方式被转运到了SSCT精子细胞中,从而影响了“借腹生殖”所产生的稀有鮈鲫精子的形态和行为特征。
为了揭示DEGs参与了哪些生物学功能,我们对上调的DEGs进行了基因本体(GO)富集分析,发现unigenes可以显著富集到几个功能项中,例如核糖核蛋白复合物生物发生、肌动蛋白聚合或解聚,以及对氧化应激的反应(图 8C)。SSCT 精子中斑马鱼衍生转录本的存在可能是 SSCT 精子和精子之间的形态和行为差异的原因。
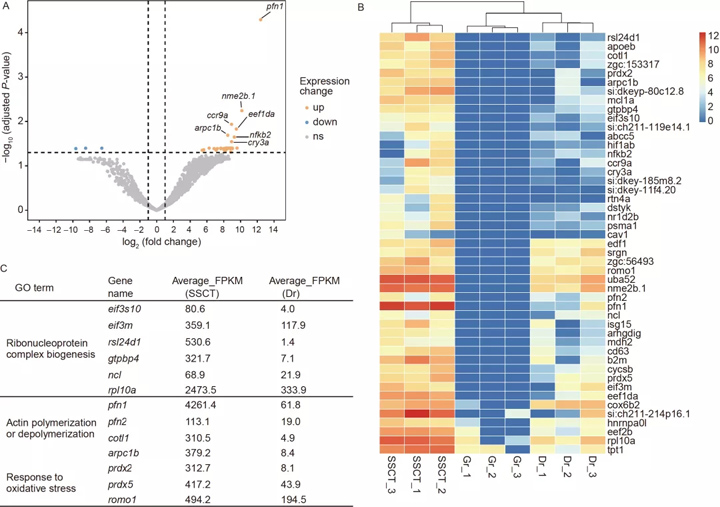
图8 SSCT 精子和精子之间的转录组学差异
三、讨论
近来,通过结合CRISPR/Cas9基因敲除和PGCs移植技术,我们成功地生成了F1代纯合突变致死基因的斑马鱼母源合子突变体。在目前的研究中,通过利用鱼类SSCT首次实现了亚科物种间的“借腹生殖”,并成功获得了跨亚科物种来源的经基因编辑的SSCT精子,这是第一份关于通过两种鱼类之间的替代亲体技术生产基因组编辑配子的报告,为斑马鱼母源基因的功能研究开辟了一条新的途径。
在以往的鱼类替代生殖研究中,不同来源的供体细胞已被用于种系移植,如含 PGC 的胚盘细胞、单个 PGC、SSC 或 OSC,并开发了不同的移植方法,如腹腔移植鱼幼虫和生殖器孔移植到成鱼。已有研究表明,不同种系供体和移植方法的不同组合可实现不同个体或不同物种间的移植,且成功率通常与供体物种与宿主物种之间的系统发育关系距离呈负相关。在所有组合中,SSCT进入鱼幼虫腹腔被认为是替代繁殖的可选策略,因为SSC可以很容易地分离、培养、冷冻保存甚至在冷冻保存后扩展。然而,当供体和宿主物种来自不同的亚科或系统发育距离较长的两个物种时,尚未有成功的SSCT报道。
在本研究中,虽然斑马鱼和稀有鮈鲫来自不同的亚科,甚至这两种鱼的繁殖时间也不同(稀有鮈鲫通常在晚上产卵,而斑马鱼在早上产卵),我们证明稀有鮈鲫SSCs 可以在宿主斑马鱼中成功定殖、增殖和分化,终导致有效产生功能性精子的斑马鱼。 通过生殖细胞诱导、SSCs分离、SSCT成功指标综合评价等一系列优化步骤,显著优化了SSCT的成功率。因此,我们的研究进一步将 SSCT 的成功扩展到了属于不同亚科的两个系统发育较远的物种。
GSCs 在代理宿主中的定殖、增殖和分化的进程对于代理繁殖的终成功至关重要,因此应清楚地描述和表征这一进程的每一步。然而,在以前的鱼类替代繁殖研究中,这种生物学过程很少被描述和研究。我们的研究中,通过使用组织学的组合、免疫化学以及 RNA技术,广泛研究了替代性腺的发育,并将其与宿主斑马鱼和供体的发育进行了比较。
研究表明,替代精巢的发育时间和整体形态与宿主斑马鱼相似,替代精巢是由来自稀有鮈鲫和斑马鱼的精巢体细胞(Leydig 细胞和 Sertoli 细胞),这进一步揭示了控制不同鱼类精巢发育和精子发生的信号通路的保守性。
在“借腹生殖”技术领域,限制其广泛应用的主要障碍应该是GSCT的低成功率。为了获得高的 SSCT 成功率,我们从供体和宿主两个方面对技术进行了优化。一方面,我们发现 4 dpf 幼虫适合替代宿主,因为 SSCT 后可以同时获得相对较高的生育率和可接受的死亡率,这就解决了之前遇到的存活率和移植效率之间的悖论;另一方面,将 mRNA 注射到供体胚胎中以诱导额外的 PGC,当 4 dpf 斑马鱼幼虫作为受体时,异种 SSCT 的成功率提高到 31.7%。该数据高于使用 2 周龄不育杂交幼虫作为受体的斑马鱼同种异体卵巢生殖细胞移植 (OGCT) 获得的成功率 (18%),甚至略高于斑马鱼同种异体 SSCT 在使用白消安治疗的成体作为接受者时 (30%),或 9–10 dpf 死路- 敲除幼虫作为接受者 (5%) 。为了进一步提升SSCT技术的成功率,体外- 扩增的 SSC 可能被视为异种 SSCT 的供体,并且免疫缺陷宿主可用于维持 SSCT 性腺发育中的免疫稳态。
在我们的研究中,RNA-seq 分析表明 SSCT 精子中存在源自斑马鱼的转录本,表明 SSCT 精巢中 RNA 的体细胞到种系传递,类似于小鼠精巢发育中的一些新发现,以及C. 线虫 。需要进一步研究以确定性腺体细胞转录的 RNA 如何转运到 SSCT 精子中,以及转运的 RNA 如何影响 SSCT 精子的发育、形态和功能。该研究也是首次利用“借腹生殖”技术产生异种来源的基因编辑配子,这为利用该技术定制未来养殖鱼类的配子奠定了坚实的理论和实验基础。
文丨Fenghua Zhang, Yongkang Hao, Xianmei Li, Yi Li, Ding Ye, Ru Zhang,Xiaosi Wang, Mudan He, Houpeng Wang, Zuoyan Zhu & Yonghua Sun
来源丨部分内容综合自《中国科学杂志社》
DOI丨doi、org/10.1007/s11427-021-1989-9