
NEWS
新闻中心
SERVERS
服务项目
发布时间:2023-08-04

编者按
乳腺纤维腺瘤(FAs)是一种纤维上皮肿瘤,常见于青春期女性,长期患有会增加患乳腺癌的风险。剖析人类乳腺FAs的病理机制对于开发更有效的治疗方法至关重要。然而,凋亡的癌细胞对邻近肿瘤上皮细胞的直接影响以及如何潜在促进治疗耐药尚不清楚。
2023年6月18日,浙江大学医学院附属第二医院、浙江省肿瘤微环境与免疫治疗重点实验室黄建、陈志刚团队在《Nature Communications》杂志发表了题为“Single cell profiling of female breast fibroadenoma reveals distinct epithelial cell compositions and therapeutic targets”的研究论文。该研究利用高通量单细胞RNA-seq分析,发现了乳腺纤维腺瘤中不同的细胞组成和上皮结构变化,证实上皮细胞可表现出激素响应功能特征,并同步激活雌激素敏感和激素抗性机制。此外,研究人员还建立了一个可扩展的患者来源的FA类器官平台,通过对通路抑制剂进行系统探究以测试FAs的治疗反应,以期为乳腺FAs提供潜在治疗策略。
原文献:Chen, Z., Zhang, Y., Li, W. et al. Single cell profiling of female breast fibroadenoma reveals distinct epithelial cell compositions and therapeutic targets. Nat Commun 14, 3469 (2023).
一、 研究背景
乳腺纤维腺瘤(FAs)是一种纤维上皮肿瘤,常见于青春期女性,长期患有会增加患乳腺癌的风险[1]。手术切除是FAs最有效的治疗措施,但可能会形成不良疤痕或广泛的导管损伤[2]。由于这类患者往往有多个病灶部位,依靠手术难以全部根除,因此迫切需要非手术的治疗措施。
FAs在临床上被认为具有激素依赖性[3]。然而,在以往的临床试验中,雌激素受体调节剂他莫昔芬的治疗效果并不理想[4, 5]。因此,剖析人类乳腺FAs的病理机制对于开发更有效的治疗方法至关重要。尽管大量测序研究已经揭示高复发FAs的突变基因并绘制出相关基因组图谱,但由于疾病本身的复杂性以及缺乏可重复的人体模型,FAs和正常乳腺组织之间上皮细胞和基质细胞转录差异的潜在机制在很大程度上仍然未知。
本研究利用高通量单细胞RNA-seq分析,发现了FAs不同的细胞组成和上皮结构变化,证实上皮细胞可表现出激素响应功能特征,并同步激活雌激素敏感和激素抗性机制。此外,研究人员还建立了一个可扩展的患者来源的FA类器官平台,通过对通路抑制剂进行系统探究以测试FAs的治疗反应,以期为乳腺FAs提供潜在治疗策略。
二、 研究结果
1、单细胞转录组分析确定了FAs的细胞组成和上皮结构特征
对4个乳腺FAs和2个配对的癌旁乳腺组织进行单细胞RNA测序(图1a),根据不同的基因表达特征,这些细胞被划分为10个细胞簇:成熟的管腔细胞(ML)、管腔祖细胞(LP)和基底细胞(BC)、成纤维细胞(FB)、内皮细胞(EC)、周细胞(PT)、T细胞(T)、B细胞(B)、骨髓细胞(M)以及未知细胞(Un)(图1b)。
与正常乳腺组织相比,FAs中的基质细胞几乎不表达激素受体,而上皮细胞则表达了高水平的激素受体。免疫组织化学染色结果证实激素受体主要在上皮细胞而非基质细胞中表达(图2d)。成纤维细胞在FAs在基质细胞中显著增多(图1c),但增殖基因(MKI67、PCNA)和KI67免疫组化染色的分析显示,成纤维细胞的增加可能不是由更高的增殖引起的。研究人员从肿瘤组织中分离出原代上皮细胞和成纤维细胞,并配对正常组织,进行上皮细胞和成纤维细胞的共培养。结果显示正常乳腺组织中的成纤维细胞可以被FA上皮募集,证明上皮细胞在FAs形成中的重要作用。
scRNA数据显示,与正常乳腺上皮细胞相比,FAs的上皮细胞组成中成熟管腔细胞扩大,基底细胞减少(图1c)。研究人员基于EpCAM和CD49f的表达组合对59例新鲜FA组织及组织和21例正常乳腺组织的上皮亚群进行表征,证实了这一现象。已知正常乳腺由外层基底细胞和内腔细胞组成[6]。FAs中基底细胞的损失表明双层结构发生了变化。这些数据表明FAs的细胞组成和结构特征与正常乳腺上皮细胞不同。
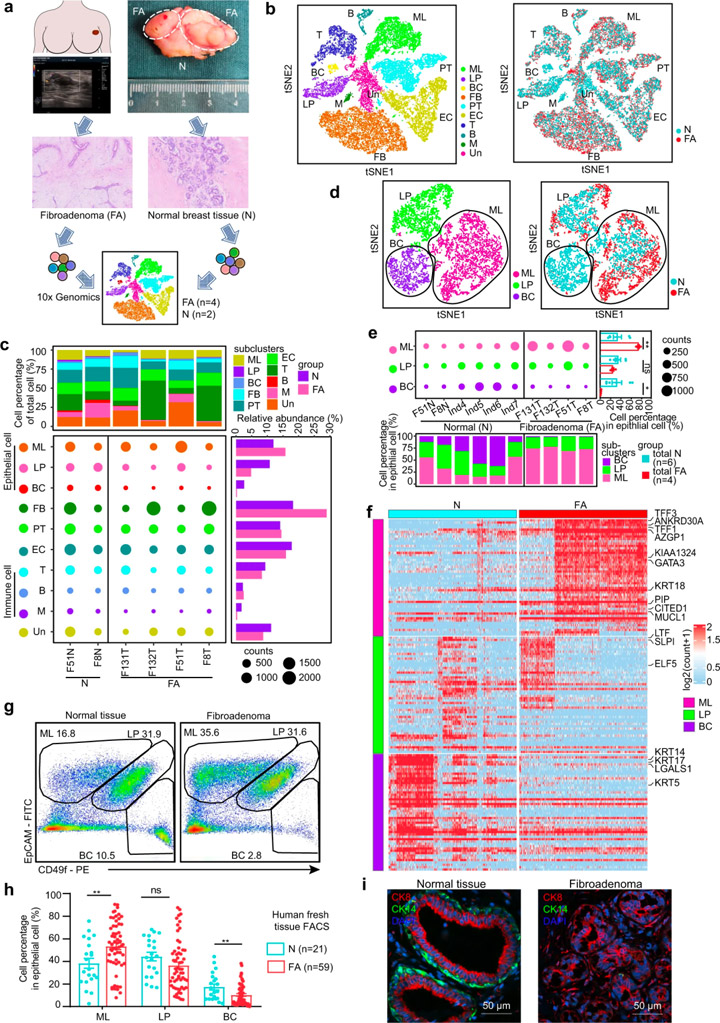
图1
2、FAs中的上皮细胞显示激素反应性特征
接着,研究人员对FAs上皮细胞群的功能差异进行探究。GO分析显示FAs上皮细胞与激素反应密切相关(图2a),基因富集显示受雌激素和雌激素诱导基因调节的TFF1和TFF3变化最为显著(图2c)。
免疫荧光和免疫组织化学染色进一步证实了FAs患者中这些激素相关蛋白的表达模式(图2d,e)。对3种不同上皮细胞类型的DEGs进行比较:(1)成熟管腔细胞上调的基因主要与激素反应信号通路相关,且管腔细胞能够响应内分泌信号或产生乳汁[7];(2)管腔祖细胞上调的基因主要与上皮细胞增殖相关;(3)基底细胞上调的基因主要与腺体发育的调节相关。这些结果表明FAs中的上皮细胞具有激素相应的功能特征。
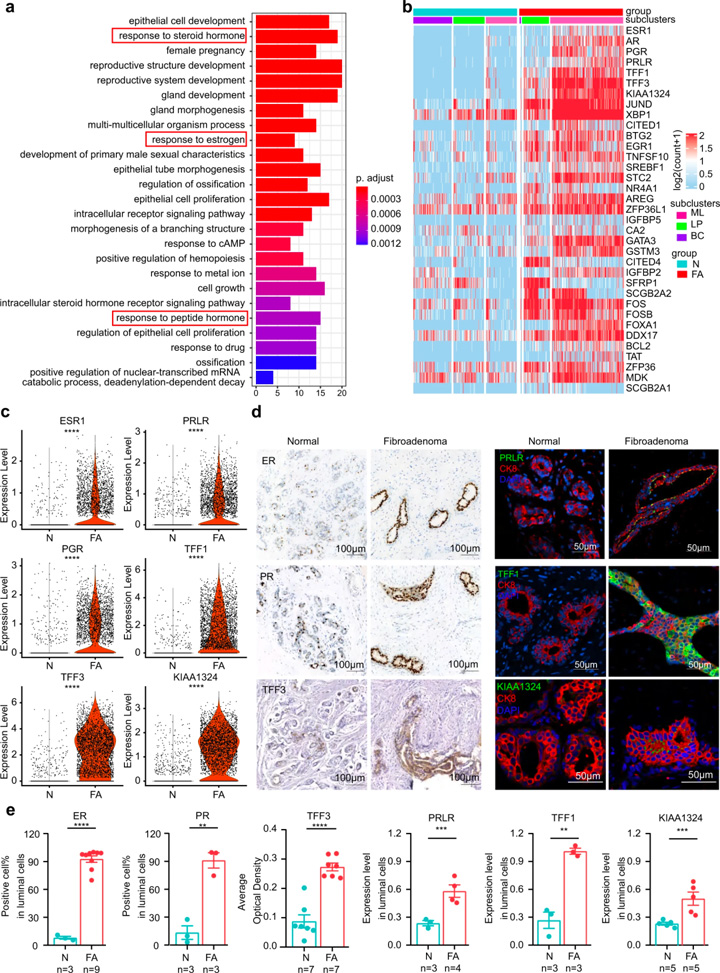
图2
3、FAs中激素敏感性和激素抵抗性共存
临床研究显示激素敏感性通路可以控制FAs[3, 8]。研究人员通过KEGG分析发现,除了激素敏感通路外,内分泌抵抗通路也参与其中,GSEA也提供了类似的结果(图3a, b)。参与内分泌抵抗性通路的基因主要分为3个功能类别:ERBB2/IGF1R、CCND1和BCL2(图3c),据报道这些基因与内分泌抵抗[9-11]及乳腺癌复发风险增加有关[12, 13]。回顾15例术后3年内同一乳房部位复发的FAs患者和9例无复发患者的资料,结果显示复发FAs组中ERBB2、CCND1和BCL2的表达水平显著高于未复发组(图3d),且与FAs复发呈正相关。此外,乳腺癌患者的ERBB2、CCND1和BCL2表达水平显著高于FAs(图3e)。
对内分泌抗性通路标志物是否存在于每个患者的上皮细胞进行探究。tSNE分析显示,每位患者的上皮细胞中均能检测到ERBB2+细胞、BCL2+细胞和CCND1+细胞。对4名FAs患者进行免疫染色,结合单细胞RNA测序以进一步验证这些发现。结果在正常人体组织中表达水平较低的激素敏感标记物(ER、TFF1、TFF3)和内分泌抵抗标记物(ERBB2、BCL2、CCND1)在FAs患者中均被检出,且样本间具有显著的异质性,提示每个受试者对内分泌治疗具有不同的敏感性。这些数据表明FAs中激素敏感性和激素抵抗性共存。

图3
4、他莫昔芬与CCND1、BCL2或ERBB2抑制剂的联合用药可显著抑制了他莫昔芬耐药FAs类器官的活力
由于激素敏感和激素耐药途径在FAs中共存,研究人员探索了为FAs患者提供个体化内分泌治疗的可能性。对39例FA患者开发了一个可扩展的类器官平台。这些类器官的组织学特征与原始FA上皮非常相似(图4b),全外显子组测序结果显示类器官总体上保留了人类纤维腺瘤的基因组结构(图4c)。RNA测序显示,相对于正常上皮,类器官和FAs之间激素敏感和激素抗性标记的转录变化相似(图4d)。
与正常乳腺类器官相比,FAs类器官中激素敏感标记物和耐药通路标记物也上调(图4d)。GSEA还揭示了人类FAs类器官中激素敏感和激素抗性通路的阳性富集(图4e)。FACS进一步证明,人FAs衍生类器官的上皮细胞与原始FAs具有几乎相同的细胞组成(图4f)。为了验证激素响应功能特征,用10 nM雌二醇处理FA衍生的类器官,显示ER响应的标志基因显著上调,且刺激了类器官的生长。这些数据表明FA衍生的类器官是激素反应性的,可作为人类FAs的模型代表,用于开发个体化内分泌治疗。
13例类器官的药敏结果显示不同患者对他莫昔芬的反应存在异质性(图4g)。大多数类器官的IC50值要高于临床他莫昔芬耐药患者。基于不同人FA衍生的类器官中他莫昔芬耐药途径标志物的差异表达,将他莫昔芬与CDK4/6抑制剂Palbociclib、BCL2抑制剂Venetoclax和ERBB2抑制剂lapatinib联合,在IC10的浓度下进行药物敏感性筛选(图4h-j)。结果显示他莫昔芬与CCND1、BCL2或ERBB2抑制剂的用药组合显著抑制了他莫昔芬耐药FAs的生存能力,为FAs的干预提供了潜在治疗方法。
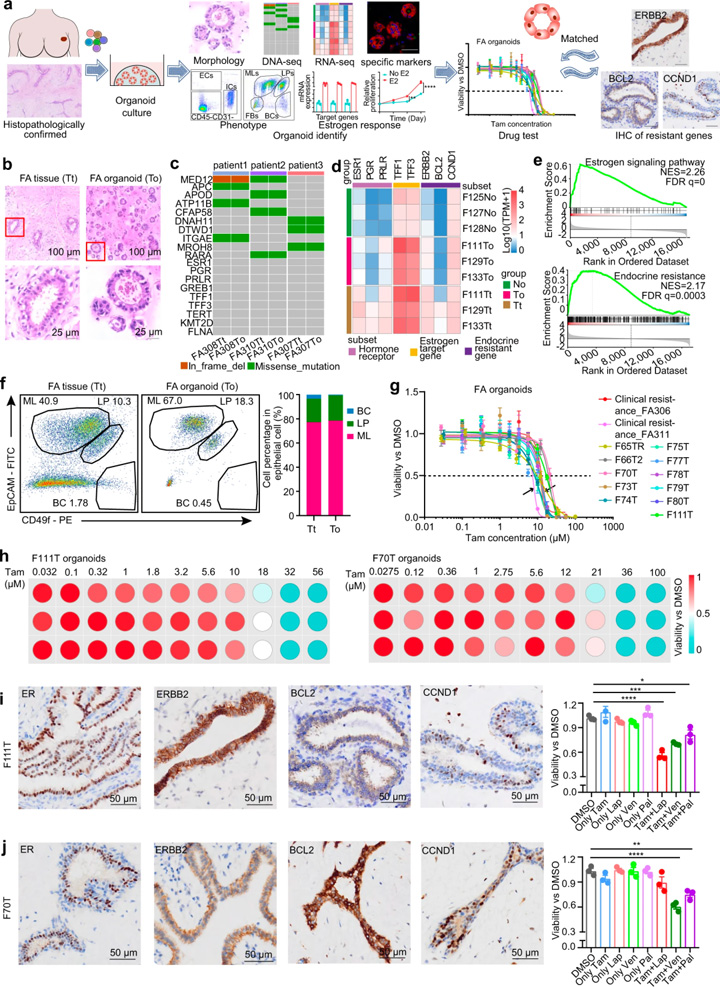
图4
作为全球斑马鱼技术应用的领导者,环特生物构建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务平台,开展科研及研究服务、智慧实验室建设和精准医疗三大业务。目前,环特类器官平台已成功搭建多种肿瘤及正常类器官的培养平台,已有多种肿瘤类器官培养试剂盒和试剂在售,欢迎各位读者垂询!
参考文献
[1] Dupont, W. D. et al. Long-term risk of breast cancer in women with fibroadenoma. N. Engl. J. Med. 331, 10–15 (1994).
[2]. Lee, M. & Soltanian, H. T. Breast fibroadenomas in adolescents: current perspectives. Adolesc. Health Med. Ther. 6, 159–163 (2015).
[3]. Yu, J. H. et al. Breast diseases during pregnancy and lactation. Obstet. Gynecol. Sci. 56, 143–159 (2013).
[4]. Viviani, R. S., Gebrim, L. H., Baracat, E. C. & De Lima, G. R. Evaluationof the ultrasonographic volume of breast fibroadenomas in womentreated with tamoxifen. Minerva Ginecol. 54, 531–535 (2002).
[5]. Bernardes, J. R. Jr., Seixas, M. T., Lima, G. R., Marinho, L. C. & Gebrim, L. H. The effect of tamoxifen on PCNA expression in fibroadenomas. Breast J. 9, 302–306 (2003)
[6]. Fu, N. Y., Nolan, E., Lindeman, G. J. & Visvader, J. E. Stem cells and the differentiation hierarchy in mammary gland development. Physiol. Rev. 100, 489–523 (2020).
[7]. Li, C. M. et al. Aging-associated alterations in mammary epithelia and stroma revealed by single-cell RNA sequencing. Cell Rep. 33, 108566 (2020).
[8]. Greenberg, R., Skornick, Y. & Kaplan, O. Management of breast fibroadenomas. J. Gen. Intern. Med. 13, 640–645 (1998).
[9]. Hanker, A. B., Sudhan, D. R. & Arteaga, C. L. Overcoming endocrine resistance in breast cancer. Cancer Cell 37, 496–513 (2020).
[10]. Choi, H. J. et al. Role of RBP2-induced ER and IGF1R-ErbB signaling in tamoxifen resistance in breast cancer. J. Natl Cancer Inst. 110, https://doi.org/10.1093/jnci/djx207 (2018
[11]. Rozeboom, B., Dey, N. & De, P. ER+ metastatic breast cancer: past, present, and a prescription for an apoptosis-targeted future. Am. J. Cancer Res. 9, 2821–2831 (2019).
[12]. Slamon, D. J. et al. Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science 235, 177–182 (1987).
[13]. Roy, P. G. et al. High CCND1 amplification identifies a group of poor prognosis women with estrogen receptor positive breast cancer. Int. J. Cancer 127, 355–360 (2010).
原文链接:https://doi.org/10.1038/s41467-023-39059-3