
NEWS
新闻中心
SERVERS
服务项目
发布时间:2020-12-18
核心摘要
小胶质细胞是中枢神经系统中的组织巨噬细胞,在免疫防御,神经发育和功能以及神经炎症中起关键作用。小胶质细胞的多功能性长期以来一直归因于异质性。近来的研究表明,人的小胶质细胞可能存在异质性,而鼠小胶质细胞则没有,但仍缺乏将小胶质异质性与功能表型联系起来的坚定证据。
在这里,我们确定了成年斑马鱼中两个不同的小胶质细胞种群,它们的形态分布,发育和功能各不相同。表达ccl34b.1的主要人群是吞噬小胶质细胞,分布广泛,呈变形虫状,高度可移动,具有吞噬作用。其他白质富集ccl34b.1 -人群,调节性小胶质细胞,具有分枝状的突起,但活动性和吞噬能力有限。这些功能上的差异是由不同的转录和响应细菌感染,其中进一步支持ccl34b.1 +在组织间隙和小胶质细胞功能ccl34b.1 -小胶质细胞释放的免疫调节剂。我们的研究揭示了小胶质细胞的异质性和功能多样化。

文|Shuting Wu,Linh T. M. Nguyen,Hongru Pan,Shaoli Hassan,Yimei Dai ,Jin Xu,Zilong Wen(香港科技大学)
文章发表于《Science Advances》 18 Nov 2020:Vol. 6, no. 47, eabd1160

一、综述
小胶质细胞是中枢神经系统(CNS)中异常多用途的免疫细胞。作为有源传感器和专业的吞噬细胞,小胶质细胞不断受到延伸和缩回它们的动态过程。因此,它们对各种中枢神经系统扰动高度敏感,包括病原体、危险信号甚至神经递质。
在刺激后,小胶质细胞经历了一系列从监视状态到效应子状态的转变,同时将其形态从分枝状转变为变形虫,称为小胶质细胞活化。这种激活过程可能导致不同的功能表型,包括先天免疫应答的差异以及与适应性免疫系统的相互作用,具体取决于刺激的类型和生理环境。由于中枢神经系统因其精细的突触结构和有限的再生能力而被视为“免疫特权的器官”,因此这些免疫反应需要严格控制。
在这方面,小胶质细胞活化可以是一把双刃剑,发挥对CNS,已在几个神经性病变,如阿尔茨海默氏病。迄今为止,在病理条件下小胶质细胞吞噬作用和炎症的作用仍存在争议。此外,除了作为清除剂的主要作用外,小胶质细胞还积极参与神经网络的模式,其他神经胶质细胞的调节和血管生成。这些胶质角色之间的小胶质细胞如何平衡仍有待进一步揭示。
由于小胶质细胞在中枢神经系统中发挥的通用功能,长期以来一直有人提出它们是异质性种群,因此不同的亚型可以发挥不同的功能。几个早期的研究中密度,形态学,几种标志物的表达,和吞噬能力(形式表示在不同CNS区域的小胶质细胞的一种可能的异质性)。但是,近来的研究(主要在小鼠中)未能支持所宣称的小胶质细胞异质性。本体论上,小鼠的小胶质细胞被认为起源于一个单一的发育起源-卵黄囊中产生的原始造血祖细胞,在早期胚胎形成过程中渗透到发育中的CNS,并在整个成年期自我更新。
从表型上看,近来的单细胞RNA测序(scRNA-seq)分析发现,来自不同CNS地区的成年小胶质细胞形成了相当均一的种群,转录组差异有限,尽管在胚胎和出生后阶段鉴定出了几个先前未鉴定的小胶质细胞亚群。在近来对小胶质细胞进行的跨物种scRNA-seq分析中,大多数检查过的哺乳动物,包括小鼠、仓鼠、绵羊、mac猴和猕猴,仅显示了一种主要的小胶质细胞类型。尽管如此,人类研究使用多维方法,包括scRNA-seq和小胶质细胞的多重质量细胞计数(飞行时间的细胞计数)在健康的人脑中发现了更大的多样性。更具体地说,而Böttcher等人确定了在不同的中枢神经系统区域富集的几种小胶质细胞亚型,发现灰质和白质中的小胶质细胞显示某些表面标记物的差异表达(DE)。这些人类小胶质细胞亚型的生物学意义仍然未知。总之,在发育,体内稳态和病理过程中,小胶质细胞的异质性以及小胶质细胞身份和功能表型的调节尚不完全清楚。
斑马鱼小胶质细胞与他们的哺乳动物对应共享高度保守的基因签名程序,并完全能够响应危险信号,清除凋亡细胞,和微调神经元活性。与小鼠小胶质细胞的单一发育起源相反,斑马鱼小胶质细胞起源于两个不同的造血波:胚胎小胶质细胞来自延髓血岛(RBI)出生的原始髓样前体,而成年小胶质细胞则起源于主动脉。-gonad-mesonephros(AGM)衍生的造血干细胞。尚不清楚这两个个体发育上不同的小胶质细胞群体在不同的发育阶段是否发挥特定的功能,因此在成年体内的小脑胶质细胞的异质性也是如此。对斑马鱼和高等脊椎动物的小胶质细胞的发育调控,规格和对不同环境刺激的适应性的比较研究可以帮助阐明有趣的小胶质细胞生物学。
我们已经在斑马鱼的大脑中确定了两个不同的小胶质细胞群体,吞噬小胶质细胞和调节性小胶质细胞,它们在形态,分布模式,起源,发育调节和功能方面均不同。据我们所知,这是脊椎动物成年中枢神经系统中小胶质细胞亚型的首个确凿证据,为小胶质细胞功能的演变提供了新的见识。
二、斑马鱼大脑中两个不同的小胶质细胞种群:
以前,我们已经揭示了Csf1ra(集落刺激因子1受体a)通过与其配体Il34的结合来调节斑马鱼中胚胎小胶质前体的迁移和定植。为了测试Csf1ra信号是否也参与成年小胶质细胞的发育,我们将缺少csf1ra的鱼的小胶质细胞表型追溯到成年小胶质细胞开始在大脑中定殖的少年阶段。受精(dpf)后20天,野生型(WT)和csf1ra -/-鱼的大脑横切面检测到csf1ra -/-鱼脑中的小胶质细胞减少但数量可观(图1,A和B)。
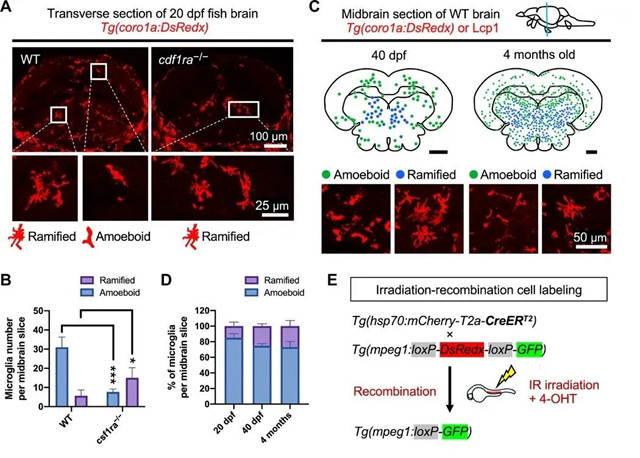
图1 斑马鱼中两个小胶质细胞种群的特征。(A)20 dpf WT或csf1ra -/-鱼的中脑横切面。底板上有变形虫或分支状的小胶质细胞。(B)量化20 dpf Tg(coro1a:DsRedx) WT或csf1ra -/-鱼的中脑横断面中的变形虫或分支小胶质细胞(n = 3)。(C)顶部:40 dpf或4个月大的野生鱼类中脑横切面上的变形虫(绿点)或分支的小胶质细胞(蓝点)的数量和分布方式。比例尺,200μm。下图:代表性的变形虫或分支小胶质细胞的放大图像。另请参见图。S1(A和B)。(D)量化20 dpf,40 dpf和4个月大的野生小鱼(n = 3)的中脑横切面中的变形虫或分支小胶质细胞的相对比例。(E)IR-LEGO-CreER-loxP细胞标记系统(26)。红外,红外。4-OHT,4-羟基他莫昔芬。
我们注意到csf1ra突变体中的小胶质细胞表现出特殊的形态和分布模式:它们是高度分支的细胞,具有复杂的突起,并且倾向于在中枢大脑中形成簇,而白质则位于其中(图1A)。在野生型鱼类的相似大脑区域也可以观察到相同种类的分枝小胶质细胞,尽管程度较小(图1,A和B)。
但是,WT大脑中还有另一种小胶质细胞分布丰富,具有变形虫的形态,突起较少,而在csf1ra -/-鱼中则明显减少(图1,A和B)。
对这两个形态和空间上不同的小胶质细胞种群着迷,我们继续在40 dpf和4个月大的野生鱼类中对它们进行了详细描述。我们发现,虽然前脑中的大多数小胶质细胞似乎是变形虫(图S1,A和B),但在中脑和后脑中很容易发现变形虫和分支形状的小胶质细胞,其形态与20 dpf的鱼相似。变形虫小胶质细胞广泛分布,分支的小胶质细胞富含白质(图1C和图S1,A和B)。
虽然在所有阶段中,变形虫小胶质细胞在数量上占主导地位,但成鱼后小神经胶质细胞的分枝小胶质细胞的比例略有增加,在成年阶段,每只中脑切片的小胶质细胞占总小胶质细胞的约20%(图1,C和D)。这些结果表明,在整个幼年和成年阶段,斑马鱼大脑中都有两个小胶质细胞种群,它们不仅在形态和分布方式上不同,而且对Csf1ra信号传导的依赖性也不同。
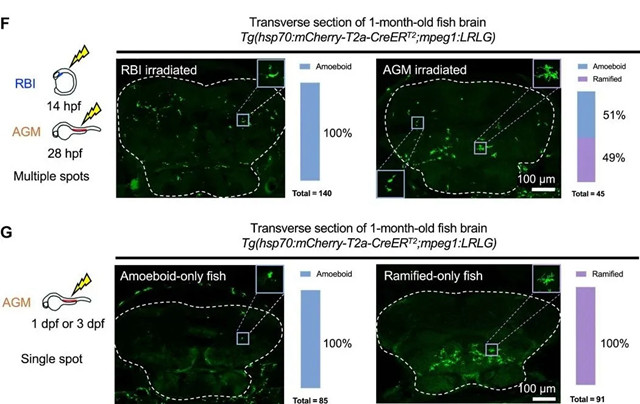
图 1 斑马鱼中两个小胶质细胞种群的特征。 (F和G)左:照射方案。RBI照射,n = 8;AGM照射,n= 3. hpf,受精后数小时。右:在1个月大的受辐照鱼的脑横切面上用绿色荧光蛋白(GFP)标记的小胶质细胞的代表性图像,虚线表示大脑,代表性的变形虫或分支的小胶质细胞在角落变大。条形图显示了每条鱼中GFP +变形虫或分枝小胶质细胞的相对比例的定量。* P ≤0.05; *** P≤0.001。
为了检查这两个种群是否仅代表小胶质细胞的不同状态(例如激活的或静止的)或两种个体发育上不同的亚型,我们询问它们在胚胎发生过程中是否分别发育。
斑马鱼中的小胶质细胞来自两个不同的起源。胚胎小胶质细胞仅起源于RBI区域中产生的原始巨噬细胞,但逐渐被第二波小胶质细胞所取代,这是由AGM区域中产生的确定性造血细胞引起的。
我们首先通过IR-LEGO-CreER-loxP细胞标记系统通过时空分辨率命运映射测试了这些不同的造血波是否对两个小胶质细胞群体做出了不同的贡献(图1E)。为了标记大多数RBI或AGM衍生的巨噬细胞,我们热休克了Tg(hsp70:mCherry-T2a-CreERT2; mpeg1:loxP-DsRedx-loxP-GFP)双转基因胚胎的整个区域,并在1个月进行了分析(图1F)。我们发现,尽管RBI和AGM辐射都标记了分布广泛的变形虫细胞,但只有AGM辐射可以标记富含白质的分枝细胞(图1F)。)
这表明变形虫小胶质细胞既来自RBI也来自AGM,而分枝细胞则完全来源于AGM。为了进一步剖析它们的发育起源,我们热休克了胚胎AGM区域中的一个小斑点,并在1个月时进行了分析,以寻找谱系偏向的标记模式。仅检测到分布广泛的变形虫细胞或富含白质的分枝细胞被标记的鱼(图1G),表明变形虫和分枝的小胶质细胞独立发生。总之,我们在幼年和成年斑马鱼中发现了两个不同的小胶质细胞群体,它们的形态,分布,Csf1r信号依赖性和发育起源都不同。
三、将ccl34b.1鉴定为小胶质细胞亚型特异性标记:
在寻找可能区分这两个小胶质细胞亚群的亚型特异性标记时,我们在成年大脑切片的候选基因中进行了原位杂交,这些候选基因在我们先前的RNA-seq分析中被证明在小胶质细胞中高度表达。
这些候选物之一,趋化因子(CC基序)配体34b,重复1(ccl34b.1),仅在中脑小胶质细胞的一部分中显示出强表达模式,其中大多数具有变形虫形态(图2A),提示ccl34b.1富含变形虫小胶质细胞。为了支持该观点,我们检查了ccl34b.1在胚胎早期的表达,当时胚胎仅包含RBI衍生的变形虫小胶质细胞(图1F)。ccl34b.1在3 dpf时在所有脑和视网膜小胶质细胞中以及在整个体内某些成熟的巨噬细胞中都强烈表达(图S2,A和B)。因此,ccl34b.1具有强大的潜力,可作为变形虫小胶质细胞的特异性标记。
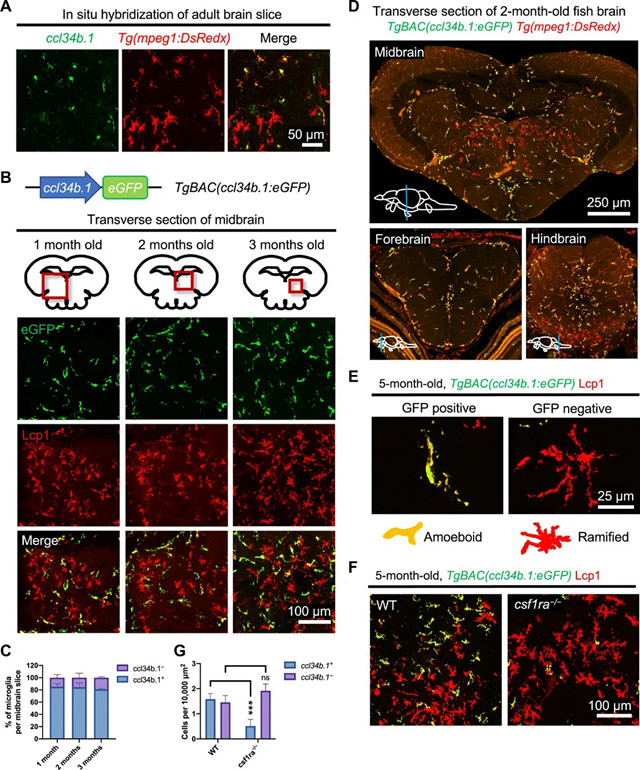
图2 表征的TgBAC(ccl34b.1:eGFP)的标记线。(一)原位杂交和免疫染色显示ccl34b.1表达(绿色)和巨噬细胞/小胶质细胞(红色)在3个月大的Tg(mpeg1:DsRedx)鱼的大脑横切面中。(B)顶部:TgBAC(ccl34b.1:eGFP)报告基因系。底部:分别通过1、2和3个月大的TgBAC(ccl34b.1:eGFP)鱼的中脑的代表性横切面。ccl34b.1 +小胶质细胞标记为绿色,巨噬细胞/小胶质细胞标记为Lcp1(红色)。成像区域的确切位置在中脑图中用红色方框表示。(C)ccl34b.1 +相对比例的定量Lcp1 +和ccl34b.1 - Lcp1 +小胶质细胞分别在1、2和3个月大的TgBAC(ccl34b.1:eGFP)鱼的中脑横断面上(n = 3)。(D)横穿两个月大的TgBAC(ccl34b.1:eGFP); Tg(mpeg1:DsRedx)鱼的中脑,前脑和后脑的横切面。(E)5个月大的TgBAC(ccl34b.1:eGFP)鱼的横断脑切片中的变形虫ccl34b.1 +Lcp1 +和分枝的ccl34b.1 - Lcp1 +小胶质细胞的代表性图像。(F和G)5个月大的TgBAC(ccl34b.1:eGFP)的中脑横断面中ccl34b.1 + Lcp1 +和ccl34b.1 - Lcp1 +小胶质细胞的代表性图像(F)和密度(G)的定量WT或csf1ra -/-鱼(n = 4)。*** P ≤0.001。
为了更好地表征两个小胶质细胞亚群,我们通过细菌人工染色体(BAC)转基因生成了TgBAC(ccl34b.1:eGFP)报告基因系,用增强的绿色荧光蛋白(eGFP)报告基因取代了ccl34b.1的大部分编码区域。(图S2C)。通过杂交TgBAC(ccl34b.1:eGFP)的带的Tg(MPEG1:DsRedx),巨噬细胞记者线中,我们验证了TgBAC(ccl34b.1:eGFP)的记者线真实夺回内源性的表达模式ccl34b.1在所有中枢神经系统小胶质细胞和部分外周成熟巨噬细胞中均以3 dpf的速度(图S2D)。
在1、2和3个月大的TgBAC(ccl34b.1:eGFP)的大脑中在鱼类中,可以容易地在整个中枢神经系统(包括脑,视网膜和脊髓)中检测出变形虫GFP信号(图2B和图S2,E和F)。
除了这些GFP +小胶质细胞,一小群GFP的-小胶质细胞,其共表达panleukocyte标记LCP1或panmacrophage标记MPEG1,在分枝小胶质细胞居住的白质区域被不断发现,其数量也与符合我们之前的网状量化小胶质细胞(图2,B至D)。
不同于广泛分布GFP +小胶质细胞,GFP -小胶质细胞在中央中脑和腹后脑中丰富,在前脑和脊髓中数量较少,在视网膜中则无法检测到(图2D和图S2,E和F)。而GFP +的小胶质细胞表现出与一些薄的突起大细胞体,GFP -小胶质细胞,与此相反,具有不可区分的细胞体和高度分支的突起(图2E)。
当我们越过TgBAC(ccl34b.1:eGFP)的报道符合csf1ra - / -鱼检查Csf1ra信号这两个小胶质细胞群体的依赖,我们发现GFP的密度+小胶质细胞,但不是GFP -小胶质细胞在csf1ra突变体中显着降低(图2,F和G)。根据发育动力学,分布模式,形态和Csf1ra依赖性,我们得出的结论是,我们已经成功建立了TgBAC(ccl34b.1:eGFP)报告基因系,该报告系专门标记了CNS中的变形虫小胶质细胞,为进一步研究其提供了有用的工具。表征这两个小胶质细胞亚群。
四、对小胶质细胞亚群细菌感染的不同反应:
为了更好地了解两个小胶质细胞群体在免疫防御过程中的生理功能,我们建立了中枢神经系统细菌感染模型。活大肠杆菌或磷酸盐缓冲盐水(PBS),连同荧光指示剂Alexa氟647染料,注入的4个月大的cerebroventricles TgBAC(ccl34b.1:eGFP)的; TG(MPEG1:DsRedx)双转基因鱼,然后在注射后6小时(hpi)对鱼实施安乐死,并进行脑冰冻切片和免疫染色(图3A)。
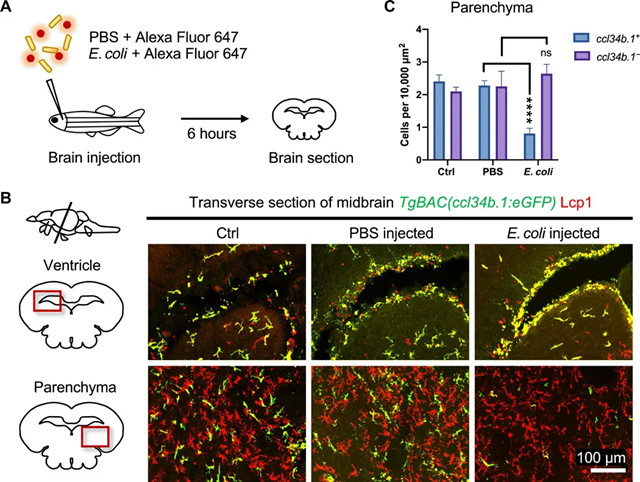
图3 这两个小胶质细胞群体对中枢神经系统细菌感染的反应。(一)实验设计。将大肠杆菌或PBS与Alexa Fluor 647染料共注入4个月大的TgBAC(ccl34b.1:eGFP)鱼的脑室中,并在6小时后收集其大脑进行冷冻切片。(B)WT,PBS注射和大肠杆菌注射的4个月大TgBAC(ccl34b.1:eGFP)鱼的中脑横切面,其ccl34b.1 +小胶质细胞标记为绿色/黄色和ccl34b。 1 -标记的小神经胶质红。成像区域的确切位置在中脑图中用红色方框表示。(C)ccl34b.1 +的密度定量和ccl34b.1 -小胶质细胞中WT鱼(中脑实质Ñ = 3),PBS注射鱼(Ñ = 6),和大肠杆菌-injected鱼(Ñ = 6)。
在注入大肠杆菌的鱼的大脑横断面,我们观察到整个大脑中ccl34b.1 +小胶质细胞的显着反应(图3B)。大肠杆菌中的ccl34b.1 +小胶质细胞并非均匀分布在不同的大脑区域,而是在所有脑室(包括前脑室,顶脑室,第三脑室)的注射部位和室下区域积聚的鱼心室和第四脑室,表明大肠杆菌诱导的炎症信号通过脑室系统扩散(图3B)。这些脑室下ccl34b.1 +小胶质细胞形态肿胀并形成簇,表明它们被激活并可能吞噬了脑室中的大肠杆菌(图3B)。
因此,与注射WT或PBS的鱼相比,其实质中的密度显着降低(图3B和C)。相反,所述的分布ccl34b.1 -小胶质细胞保持不变,所以没有它们的密度在实质(图3B和C)。这些观察结果与急性脑切片培养所揭示的独特行为动力学高度一致。因此,我们的理由是,高移动性和吞噬ccl34b.1 +小胶质细胞在组织清理后的细菌感染扮演着重要的角色,而流动性较差的ccl34b.1 - 小胶质细胞可能间接调节炎症。
五、讨论
在这项研究中,我们已经确定了斑马鱼在少年和成年阶段的两个不同的小胶质细胞群体,它们在细胞表型、发育、行为和功能方面表现出不同的特征。我们的研究为脊椎动物小胶质细胞的异质性和功能多样化提供了迄今为止的头一个可靠证据,为有趣的小胶质细胞领域增加了新的复杂性。尽管这项研究已经表征了几个显着的特征,但是还有很多地方有待发现。
要解决的紧迫的问题之一是在较高的脊椎动物,特别是哺乳动物中是否也存在类似的异质小胶质细胞种群。而在小鼠和其他哺乳动物近来scRNA-seq的分析表明,在这些品种成人小胶质细胞是相当均匀,更高的异质性已经在人类小胶质细胞。但是,报告的人类小胶质细胞异质性代表小胶质细胞的不同状态还是不同的种群,需要进一步研究。
此外,几种类型的脑巨噬细胞(血管周围,脑膜和脉络丛巨噬细胞)占据着独特的中枢神经系统壁,对中枢神经系统的稳态具有重要作用,但在斑马鱼中却表现不佳。尽管在脑室周围区域发现了一部分ccl34b.1 +细胞(图3),但大多数ccl34b.1 +和ccl34b.1 -小胶质细胞存在于软组织,但不包括这些调用代表在哺乳动物大脑识别巨噬细胞的不同群体的可能性。综上所述,关于小胶质细胞的反复无常的功能表型及其多功能作用,斑马鱼的两个小胶质细胞群体内的清晰区室化为解决各种挑战性问题提供了有价值的模型,从而补充了其他物种的小胶质细胞研究。
结果表明,斑马鱼的两个小胶质细胞种群之间的主要差异之一是它们的形态。所述ccl34b.1 +吞噬小胶质细胞是具有大的胞体,只有少数细突起相对变形虫,而ccl34b.1 -调节性小胶质细胞表现出复杂的、突起的形态。
这种差异是有益的,因为小胶质细胞的形态通常指示其功能状态。例如,在中枢神经系统发育过程中,小胶质细胞呈现出一种变形虫形态,具有更高的吞噬能力和独特的分泌模式,可有效去除凋亡神经元和接线不当的神经网络。作为CNS的成熟,小胶质细胞通过主动地发送突起(获得网状的形状,静息的小胶质细胞在成人CNS中占主导地位的形态,不断surveil环境)。分枝的小胶质细胞可以响应危险信号而切换回变形虫形态,同时改变其分泌特性。这种激活表型可以有效地去除入侵的病原体和其他损伤,但是如果失调,也可以发挥组织破坏作用,这在神经病理学中很常见。
我们在这里表明,变形虫ccl34b.1 +吞噬小胶质细胞具有高吞噬能力和流动性,而网状ccl34b.1 -调节小胶质细胞积极重塑其突起;然而,在何种程度上这些细胞类型等同于活化的小胶质细胞或静息的小胶质细胞仍不清楚。尽管如此,这些小胶质细胞的不同表型表明它们可能在生理和病理条件下具有互补功能,因此提供了一个有趣的场景来剖析每种细胞类型的确切作用,并有助于获得对变形虫和分枝小胶质细胞的动态作用的新见解。一般来说。
另一个有趣的线索来自两个小胶质细胞种群的分布模式。区别于分布广泛,流动性很强ccl34b.1 +吞噬小胶质细胞,ccl34b.1 -调节小胶质细胞从脑到后脑延长白质丰富。该区域具有许多束和连合,上升和下降的投影以及网状结构,网状结构是复杂的有线神经元网络,其相互连接不同的大脑区域,对于运动控制以及维持唤醒和意识至关重要。ccl34b.1的巧合-在该区域大量发现的调节性小胶质细胞强烈表明,这些小胶质细胞可能通过调节神经突的发育或髓鞘形成来帮助完善网络。小胶质细胞表达的基因为维护和神经分化和神经胶质祖细胞,以及在脑的异常功能障碍或耗尽这些小胶质细胞的结果,其中包括在胼胝体背胼胝体轴突,前脑多巴胺多巴胺能神经轴突的缺陷神经支配,并且在皮层网络(的interneurons的不正确定位的defasciculation)。这将是有趣的剖析可能的功能ccl34b.1 -调节小胶质细胞在不同脑区的斑马鱼线。
除髓主调节PU.1 / SPI1的ccl34b.1 -调节小胶质细胞表达的几个转录因子(例如,相当水平IRF8,id2a和batf3为树突状细胞的发育(DCS))是必要的,对于T细胞活化重要的专业抗原呈递细胞。尽管硬骨鱼的DC的特征仍然很差,但近来在鳟鱼中的研究发现,CD8α + MHC II + DC样亚群具有皮肤,呼吸表面和肠中DC的表型和功能特征。这些DC样细胞也表达IRF8和batf3,关键转录因子的DCs了在富集ccl34b.1 -调控的小胶质细胞。
无论ccl34b.1 -调节小胶质细胞共享外围DC-样细胞仍然是一个有趣的问题,同样的细胞系。然而,DC的核心调控元件的表达强烈表明ccl34b.1 -调节性小胶质细胞可具有DC的一些功能特性。与此观点一致,ccl34b.1 -调节小胶质细胞表达在稳态和炎性条件下参与T细胞调节的几种基因。例如,它们表达高水平的ccl19a.1,一种趋化因子在将淋巴细胞募集到淋巴器官中起重要作用。它们还表达il12ba,其与哺乳动物的同源性主要由DC分泌,并且可以刺激哺乳动物T辅助细胞的分化。在高表达的另一种可能的T细胞调节基因ccl34b.1 -调节小胶质细胞是siglec15l(唾液酸结合免疫球蛋白样凝集素15,等),其直系同源人已报道作为用于T细胞的关键免疫抑制。
在可能的作用ccl34b.1 -在T细胞的调控监管的小胶质细胞的事实进一步支持了,在急性细菌感染, ccl34b.1 -调节小胶质细胞上调CXCL11家族的表达( cxcl11.3, cxcl11.7, cxcl11.6, cxcl11.1,和cxcl11.5),其直系同源物的哺乳动物已经报道促进T细胞,自然杀伤细胞和巨噬细胞到感染部位。ccl34b.1之间的潜在相互作用- 调节性小胶质细胞和适应性免疫系统,尤其是T细胞,仍然是一个有趣的话题。
参考资料:
[1] A. Sierra, F. de Castro, J. delRío Hortega, J. Rafael Iglesias-Rozas, M. Garrosa, and H. Kettenmann, “The‘Big-Bang’ for modern glial biology: Translation and comments on Pío delRío-Hortega 1919 series of papers on microglia.,” Glia, vol. 64, no. 11,pp. 1801–1840, Nov. 2016.
[2] S. Wu, R. Xue, S. Hassan, T. M.L. Nguyen, T. Wang, H. Pan, J. Xu, Q. Liu, W. Zhang, and Z. Wen, “Il34-Csf1rPathway Regulates the Migration and Colonization of Microglial Precursors,” DevelopmentalCell, vol. 46, no. 5, pp. 552–563.e4, 2018.