
NEWS
新闻中心
SERVERS
服务项目
发布时间:2021-05-25
核心摘要
斑马鱼(Danio rerio)自20世纪50年代被引入科学研究后,已成为研究再生过程和机制的一个有价值的模型。斑马鱼表现出异形再生,即截肢后形成的未分化细胞团能够完全再生失去的组织,如四肢、心肌、大脑、视网膜和脊髓。斑马鱼的肢体再生过程包括几个阶段,其特征是特定信号通路的激活和基因表达。本文以斑马鱼为模型,对影响肢体再生的关键因素进行了综述。

一、斑马鱼概述
斑马鱼是鲤科的一种小型热带鱼类,生活在印度、孟加拉国、缅甸和尼泊尔的淡水河流和池塘中。斑马鱼作为一种模式生物在20世纪30年代初被引入科学。由于体外受精和能够使大部分受损组织完全再生,斑马鱼被广泛用于揭示脊椎动物胚胎发育和再生的机制。
斑马鱼具有体积小、繁殖快、养殖方便、养殖成本低等特点,因此在生物和生物医学科学的主要领域得到广泛应用。1951年,在PubMed上发表了7篇与斑马鱼相关的论文,到2019年增加到3911篇。尽管斑马鱼不能取代哺乳动物家鼠、小家鼠、灰鼠、褐家鼠,但在再生过程的研究中,它已经取代了爪蛙,发表了269篇文章,而2019年发表了29篇。
癌症、肥胖、压力、再生、糖尿病、心血管疾病和其他常见疾病可以通过使用斑马鱼进行研究。斑马鱼不仅是一种模式生物,而且还是一种实验对象,被广泛用于检测化学制剂的毒性以及土壤和水的污染。斑马鱼的一个主要特征是它能够完全恢复受损的器官和组织,如鳍、心肌、视网膜和肌肉,使它们可以用于探索细胞内机制,以实现假设和实际目的。
二、斑马鱼早期及当前研究实践
涉及组织再生的复杂过程和机制一直是生物学上一个重要的正在进行的课题。公元前8世纪,希腊诗人赫西奥德介绍了普罗米修斯,他的肝脏每天都被老鹰伊顿啄出,但第二天早上就完全再生了。亚里士多德在他关于自然史的文章中提到,动物胚胎的再生效率比成人高。几个世纪后的1744年,日内瓦的一位博物学家和动物学家亚伯拉罕·特伦布利)出版了一本关于九头蛇再生过程的书。通过连续切片,他证明了亚述德拉冈可以从身体的一小块碎片再生。
直到20世纪,托马斯·摩根描述了水螅和蠕虫的观察结果,并阐明了两种类型的再生的基本原理:形态轴和形态上的。形态轴是息肉的常见表现形式,在息肉中,原有的细胞在受伤后立即重组,以重组身体失去的部分。鱼类、两栖动物和爬行动物的四肢再生是异形的,在这个过程中,未分化的细胞群迁移到受伤部位,形成胚基,并迅速增殖成被切除的器官。
后来的实验检测了干细胞在这一过程中的作用,并确定了再生的阶段。分化和脱分化是调节组织和器官再生的两个关键过程。开始在组织损伤或截肢后,多能干细胞被激活,损伤部位附近的分化体细胞转化为单能干细胞并开始分裂。这些单能干细胞随后去分化为体细胞,取代受损的结构。
目前,科学家们和过去一样,专注于识别哺乳动物(主要是人类)受损器官恢复正常功能的机制,这些动物具有较低的再生潜力。
人体器官按再生能力可分为高等再生的器官(血液和皮肤);中等再生器官,有物理创伤后再生(骨,肝和骨骼肌);和低等再生器官(神经系统,心肌和肌肉)无法再生失去的细胞。由于缺乏再生潜力,第三类器官的任何退化过程都会导致严重残疾或死亡。心脏病发作、截肢(尽管人类和老鼠的胎儿可以自发地再生趾尖)或神经元退化的影响是永久性的。尽管人们对其分子机制有所了解,但再生过程的调控机制仍不完全清楚,但众所周知,纤维化组织的形成是限制器官修复的关键因素。
传统上认为,只有无脊椎动物和低等脊椎动物可以再生器官,而高等脊椎动物,除了爬行动物和两栖动物,都没有这种能力。墨西哥钝口蝾螈、爪蛙和一些种类的蜥蜴,包括华丽的缝隙龙、Ctenophorus ornatus和特内里费蜥蜴的幼崽,可再生尾巴、肢芽、眼晶体和神经元。即使在表现出非凡再生潜力的生物体中,斑马鱼也表现出非凡的能力来修复失去的结构,并显示出作为心脏、视网膜、皮肤和大脑再生医学研究模型的高潜力。
与大多数羊膜动物(包括鸟类和哺乳动物)不同的是,胚胎和成年斑马鱼的再生过程不需要用纤维组织替换受伤部位。没有这一过程,器官就可以重新发育,心肌、眼睛、鳍和其他重要器官的功能也可以完全恢复。
三、斑马鱼尾鳍再生
哺乳动物与鱼类不同,两栖动物,如美西螈,在整个生命的后阶段都不能再生四肢。尽管在无羊膜动物和羊膜动物中,负责肢体再生和诱导体细胞和干细胞去分化、增殖和分化的关键基因是相似的,但在哺乳动物中,这些基因在截肢后不被激活。
在无羊膜动物中,截肢部位通常被疤痕覆盖,疤痕不能代替失去的肢体,也不能保护潜在的重要器官和正常功能的皮肤。与无羊膜动物相反,羊膜斑马鱼是研究异形再生的理想模型,在这个模型中,前体细胞活动、迁移、形成未分化的细胞团,增殖、分化,完全恢复被切除器官的大小、形态和功能。多次截肢并不会降低斑马鱼的再生能力。
尾鳍之所以被许多研究人员选择作为研究对象,是因为尾鳍的特性可以清楚地研究其再生过程。它是斑马鱼超大的鱼鳍,便于操作和观察。鳍生长的研究不需要试剂或设备。
尾鳍有两个叶,可以是异尾的或同尾的,这这样就可以不依赖于鱼的身体,沿着鱼的内侧轴监测它的生长。与两栖动物或哺乳动物的四肢相比,鳍的解剖结构更简单。再生过程在14-28天内完成,取决于水质、温度、饲料、病原生物入侵和饲养密度。
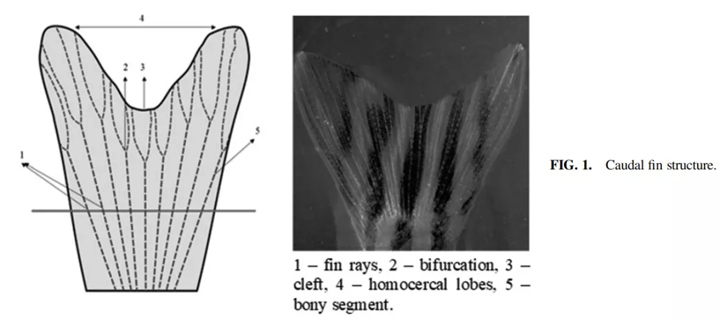
斑马鱼的尾鳍与臀鳍、背鳍、胸鳍类似,属于硬骨型,由成骨细胞和成纤维细胞组成。鳍的主要结构组成部分是一个分节的、钙化的圆柱形射线,远端是中空的,产生并排列在内外两侧的成骨细胞上,与结缔组织相对,而结缔组织构成了大多数鱼类的鳍的外层。所述鳍条在近端具有一个未分段的区域。每个鳍段(鳞翅目)由两个被称为半刚体的凹段组成,由柔性纤维连接。
鳞毛菌由成纤维细胞、血管、色素细胞和神经元组成。它们被表皮覆盖,并由关节连接。大多数近端节段由矿化基质支撑,但形成每条射线远端尖端的三到四个节段没有骨基质,而是由称为放线菌的非钙化针状体支撑。
由于放线菌的主要成分弹性素中含有胶原和非胶原成分,鳍具有刚性和柔性。放线菌提供一层膜来支持骨基质,形成运动器官。鳞屑毛的形成虽然落后于放线菌,但放线菌是成骨细胞迁移和分化的必要因素。由成纤维细胞产生的薄薄的皮肤褶皱覆盖了所有的鳍条,允许它们收缩和释放,从而减少或增加鳍的面积。
对运动至关重要的肌肉附着在半营养体的基部。斑马鱼的尾鳍由16-18条鳐组成。裂外侧线和内侧线的区别大约有四段。在鱼的整个生长过程中,光线通过在远端增加新的节来生长(如下图1)。
斑马鱼的鳍再生过程分为五个阶段:尾鳍丢失后,为了减少负面影响,必须抑制损伤部位的出血,防止微生物的扩张,其中许多微生物可能对鱼类具有致病性。
为了吸引免疫细胞到伤口,头一个危险信号是由活性氧(ROS)发出的,它在截肢部位起着趋化作用。然后一系列重叠的信号分子,包括趋化因子,吸引免疫细胞,基本上是中性粒细胞,在几分钟内到达。如果血管遭到破坏,中性粒细胞就会形成血凝块来止血。此外,中性粒细胞在损伤部位聚集并清除抗原碎片(如下图2)。
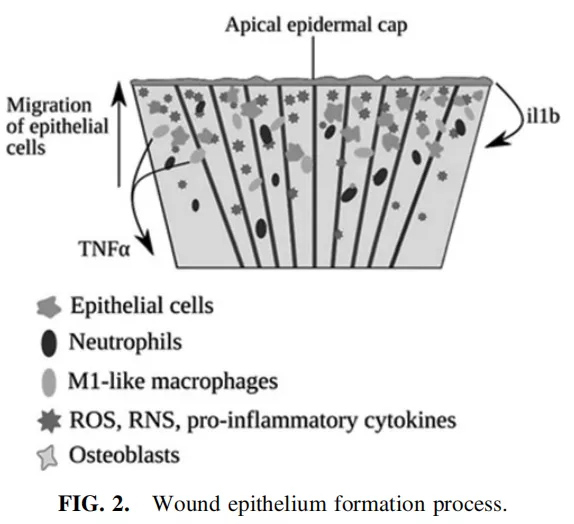
骨髓细胞在鳍再生中的作用尚不完全清楚,然而,近来的一项研究显示巨噬细胞和中性粒细胞向损伤组织迁移的时间依赖方式。以往的研究表明,中性粒细胞消融可导致再生率的升高,而二苯碘氯铵抑制中性粒细胞补充到损伤部位并不影响组织修复率。另一方面,巨噬细胞清除作用导致尾鳍生长显著减少,鳍形态发生改变,包括异常的组织生长区域、骨射线模式缺陷和异质骨钙化。
巨噬细胞是免疫系统的第二个主要角色,它调节组织内稳态,器官修复和血管生成,迁移到伤口并分泌生长因子和细胞因子。进而激活细胞外基质(ECM)产生,该产物存在于所有组织中并调节伤口的愈合,从而提供保护受损区域的贴剂。
与斑马鱼和其他完全再生的物种相反,哺乳动物在截肢后通过纤维连接蛋白和胶原蛋白(ECM的主要成分)的沉积形成瘢痕组织,导致纤维化。在斑马鱼中,当尾鳍截肢后的出血停止后,纤维蛋白和纤维连接蛋白的数量就会减少,这是防止瘢痕形成的原因,因为当伤口闭合时,被称为基质金属蛋白酶(MMPs)的蛋白水解酶会重塑基质蛋白来保护愈合的器官或组织,以及迁移的细胞来取代失去的组织。
虽然基质金属蛋白酶参与组织重塑、细胞迁移和增殖、血管生成和凋亡以及ECM蛋白降解,对正常胚胎发育至关重要,但它们在肢体再生中的作用却鲜有报道。研究表明,再生尾鳍的芽基和基底上皮层均表达MMP基因,而抑制MMP活性的酶GM6001的存在导致了鳍生长受限。研究还表明,MMP酶影响趋化因子的激活,这些趋化因子刺激免疫细胞向损伤部位迁移,维持正常的稳态,并在胚胎发生和再生过程中控制细胞迁移。增加GM6001浓度导致白细胞减少,负调控对损伤的免疫反应。
Hasegawa等研究了促炎细胞因子白细胞介素-1β (illb)对幼虫鳍褶再生的影响。并发现尾鳍截肢导致上皮细胞中illb表达增加,从而触发再生诱导基因。然而,在没有巨噬细胞的情况下,该细胞因子的过度表达导致再生细胞凋亡。因此,巨噬细胞在再生过程的后续阶段中起着重要的作用。另一种促炎细胞因子TNF-α被认为是尾鳍再生的重要组成部分。作为Wnt/ b-catenin信号通路的下游元素,这种抗炎细胞因子由M1样巨噬细胞合成到损伤区域,具有增强巨噬细胞积累和参与胚芽形成的双重作用。
透明质酸在再生鳍的ECM中非常丰富。透明质酸合酶3 (has3)基因在尾鳍截肢后6小时内表达,24小时内增加到其超大浓度。由该基因编码的蛋白质产生分子量不同、具有不同生物学功能的透明质酸。短的透明质酸聚合物与鳍再生有关。在截肢后24小时抑制透明质酸的合成会抑制胚泡的形成和再生,而在后期抑制则不会显著影响再生过程。研究结果表明,透明质酸分子会激活胚泡形成所需的信号级联,因为抑制了透明质酸的合成。消除了某些母细胞特定的标记。
在1-3天内,该部位被远端不扩散的上皮细胞形成的多层伤口表皮覆盖。随着时间的推移,伤口表皮增加规,并建立了顶端表皮盖,这在以下方面起到了一物理屏障的作用。在18-24小时,伤口表皮下的间充质细胞,主要是成骨细胞和成纤维细胞,失去其组织并转变为高度增殖的白色未分化细胞,称为胚芽。胚芽在2天的过程中会增大。
建立合适的胚芽对于正常的再生至关重要,包括血管、神经、骨成分和结缔组织的正常再生,所以当初的48 h至关重要,必须适当激活所有启动再生的主要机制(如下图3)。
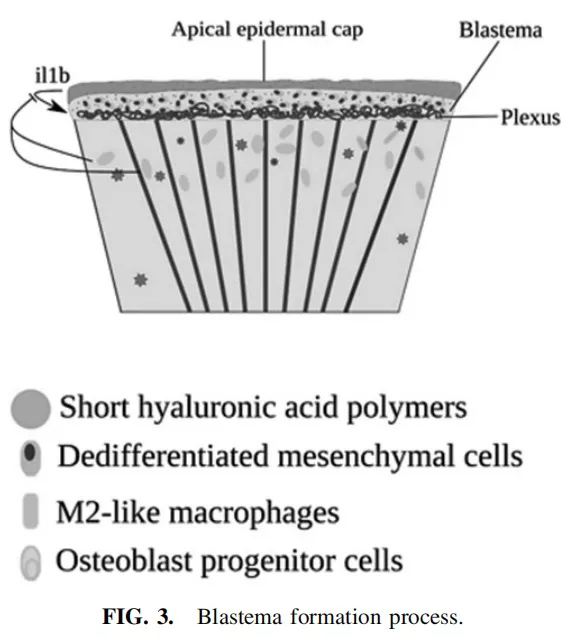
胚芽有两种功能:支持生长和形成鳍恢复所必需的特定结构元素,主要受wnt /b-catenin、声波刺猬(Shh)、成纤维细胞生长因子(FGF)、骨形态发生蛋白(BMP)、激活素、胰岛素样生长因子(IGF)、Notch和RA(维甲酸)通路的调控。
Hedgehog基因是脊椎动物胚胎发育的关键调控因子,它启动适当的成骨细胞祖细胞(pObs)分化和鳍射线分叉,从而调节基底上皮细胞和pObs之间的细胞间相互作用。Shh的激活使表皮细胞暂时分裂成簇。护送成骨祖细胞(pObs)再生具有典型分支结构或分叉的空心圆柱形骨射线。在甾体生物碱环巴胺的作用下,Shh被阻断,可导致畸胎瘤和肿瘤减少。如果Shh过度表达,会导致肿瘤、不适当的细胞增殖和再生鳍过度的骨沉积。环巴胺抑制损伤组织中Shh信号通路,导致Wnt/b-catenin、FGF和RA基因表达受到抑制,从而导致再生能力丧失。然而,Wnt通路的激活导致再生过程的恢复。因此Shh是该通路的上游调控因子。
在胚芽建立的水平上,调节干细胞多能性的典型信号通路Wnt/b-catenin对胚芽形成至关重要,而胚芽形成又对进一步的发育至关重要。Wnt/b-catenin只在胚基远端有限数量的非增殖细胞中起作用,并直接调节成骨细胞分化,从而影响骨形成。有人提出,除了Wnt/ b-catenin信号转导功能外,还要在胚芽内建立组织中心,从而调节胚芽的活性。其他信号通路,如Fgf和Bmp,他们控制细胞的增殖、分化、和组织恢复。长期抑制Wnt/b-catenin信号通路会阻断断鳍的再生生长。
Wnt/b-catenin抑制剂糖蛋白Dkk1的超表达可抑制肿瘤发生和细胞增殖,导致胚芽形成停止,通常还会导致再生过程停止。据报道,这种拮抗剂可调节爪蛙X.的心脏组织形成。可见,敲除Dkk1基因会导致小鼠胚胎发育过程中肢体和大脑发育受损。因此,正常的Wnt/b-catenin/Dkk1相互作用似乎是鳍再生启动成功所必需的。随着Dkk1暂时性的过度表达,重复截肢重新启动了正常的再生过程,导致了正常的结构恢复。有趣的是,远端芽基细胞在再生组织中产生Wnt蛋白梯度,直接或间接地调节各种细胞群。
FGF在鳍再生的早期阶段表达,并控制成骨细胞的形成、成骨细胞的去分化和增殖、放线菌的再生以及随后的鳍的恢复。FGF通路调控错误会导致严重的异常,如肿瘤。成纤维细胞生长因子受体(FGFRs)对细胞的有效再生有重要作用。FGFR1对于维持表皮细胞和胚细胞亚群以启动胚基增殖至关重要。在fgf20a基因被暂时敲除的突变斑马鱼中,上皮细胞覆盖了损伤部位,但没有被胚芽细胞取代,这与野生型鱼类似。这一修改在48小时停止了再生过程。伤口完全愈合了,没有复原失踪的鳍。FGFRs的暂时抑制导致节段间关节和骨单元的病理变化。使用热休克或化学试剂在截肢后2天抑制offgf信号通路导致胚基发育不全,这证明了FGF不仅对重新合成至关重要,而且对维持现有的蛋白质结构也至关重要。该途径激活后,包括芽基和放线菌在内的所有结构均可重新启动再生过程,重建其结构和功能。
Notch信号通路是胚胎发生过程中细胞稳态的普遍调节因子,对维持成体组织的完整性非常重要。通过细胞间的相互作用,Notch通路控制邻近细胞的发育,并调节它们的自我更新、生长、生存、分化和通过凋亡死亡的能力。近来的研究表明,再生过程的控制依赖于维持胚细胞的增殖状态。我们发现Notch在尾鳍截肢时被激活,但不参与芽基形成后的细胞迁移或去分化。
Bmp包含了一个来自转化生长因子-β家族的大亚群配体。在人类中,BMP信号是由BMP二聚体结合到细胞表面的多聚复合体开始的,该多聚复合体由具有丝氨酸/苏氨酸激酶活性的BMP受体1型和2型的同源二聚体组成。配体结合后,BMP受体1二聚体磷酸化BMP受体2二聚体,并启动其激酶活性,刺激下游介质的作用。BMP受体磷酸化的主要靶点是SMAD蛋白,这是一种从细胞质转移到细胞核的纤维化调节蛋白,在细胞核它们以SMAD结合基序与DNA结合,导致组织特异性基因表达。几乎所有类型的再生鳍组织中都表达了1型Bmp受体的不同同源物。
BMP在远端胚、伤口表皮、成骨细胞和再生组织的血管中具有活性。当初,Bmp对神经丛的血管重塑至关重要。此外,它促进胶原纤维沉积到基膜,同时关闭伤口,诱导光化毛的形成。1型受体的药理抑制可导致芽基形成后3 dpa再生阻滞,影响伤口表皮结构。伤口表皮Bmp通路的损害阻碍了放线菌的形成。Bmp信号的抑制导致毛细血管形成异常,导致血液循环受损。
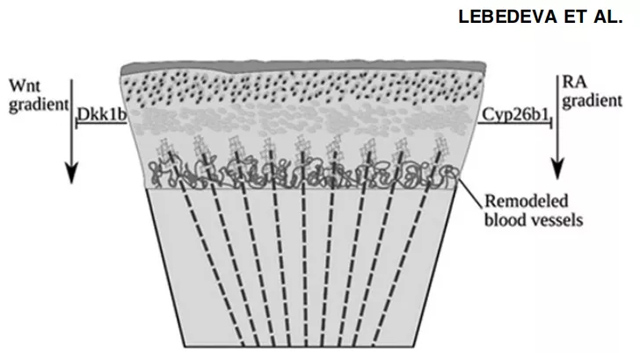
RA是斑马鱼骨再生过程中成骨细胞再分化和去分化的重要效应分子。在生长过程中,RA正向调节成骨细胞的骨基质合成。在尾鳍内建立了骨基质合成和降解之间的平衡,以提供柔性和刚度的很好组合。在未损伤的尾骨中,这种平衡主要由两种蛋白质控制:合成RA的成纤维细胞中的Aldh1a2和降解RA的成骨细胞中的Cyp26b1。截肢后,RA信号应被Cyp26b1抑制,以提供成骨细胞去分化所需的条件。
然而,成骨前细胞的增殖受到RA的正调控,阻止它们的再分化,并可能干扰BMP信号,上调Wnt/b-catenin通路。前成骨细胞的再分化是由于近端产生Cyp26b1的囊胚细胞产生近端至远端RA浓度梯度,而RA主要分泌在远端。近来的一项研究表明,NF-jB是成骨细胞去分化和再分化过程中RA信号的上游调控因子。Mishra等人提出了一个模型,根据该模型,在截肢后,由于未知的损伤诱导信号的作用,NF-jB被下调。下调NF-jB诱导成骨细胞中cyp26b1的表达,刺激其去分化(图4)。
IGF是进化上的保守蛋白,调节细胞生长、存活和代谢过程。IGF信号通路的作用主要通过IGF-1受体介导,IGF-1受体具有酪氨酸激酶活性,与配体结合后可磷酸化下游靶点。IGF信号通路的下游级联包括Ras-MAPK和PI3-kinase通路。Chablais和Jazwinska证明了建立正确的IGF信号是鳍再生的必要条件。其中,胰岛素样生长因子2b (igf2b)在72小时的胚芽表达量比断肢组织增加了5倍。有趣的是,IGF1型酪氨酸激酶受体(IGF1R)的激活不是在胚芽中,而是在伤口表皮中。使用morpholino寡核苷酸和IGF1 atp结合位点的药物阻断剂抑制IGF信号,可导致异常的再生,损伤或截肢后24小时,再生率降低42%-48%。由于IGF1R活化的抗凋亡作用,IGF信号可能对创面表皮的建立起重要作用。例如,伤口表皮形成过程中抑制IGF信号与55- 95倍的凋亡增强有关。然而,如果鱼在伤口上皮形成后使用igf1r抑制剂,则不会出现大量的细胞凋亡。尽管没有igf1rinblastema的调控,但抑制这一信号通路会导致细胞增殖缺陷和囊胚标记物msxB和fgf20a的表达缺失。
激活素是一种配体,属于TGF-β家族。这些配体与激活素1型和2型受体的结合触发Smad蛋白的激活,这是由于受体胞内区域的丝氨酸/苏氨酸激酶活性。激活后,Smad复合物改变了细胞核中多个基因的表达。激活素信号在斑马鱼再生中起重要作用。Jaz´win´ska等人证明,与若干TGF-β配体(TGFβ1、TGFβ2、TGFβ3)基因和节点相关基因相比,后鳍中激活素- βA的转录显著上调。在24小时,activin-βA表达峰值为18小时(增加18倍),而在24小时时略有下降。在胚基形成之前,激活素1型受体的药理抑制导致了受损的伤口边缘修复,这是由于有缺陷的间充质重塑,与未受抑制的对照组相比,细胞增殖减少了75%。在囊胚形成后,用激活素1受体抑制剂处理截断的斑马鱼,在12小时内可显著降低囊胚细胞的增殖,并降低24小时后囊胚标记物msxB的表达。通过使用activin-βA和寡核苷酸对激活素信号通路的损害,Jaz´win´ska和同事发现再生能力降低了50%-80%。因此,即使在正常启动过程之后,鳍生长过程中激活素信号的损伤也导致再生缺陷。
为了使间充质细胞去分化,强甲基化基因必须通过DNA甲基转移酶(dnmt)的作用去甲基化,该酶从胞嘧啶中去除甲基基团,将异染色质转化为其活性形式常染色质。调查显示5-甲基胞嘧啶和5-羟甲基胞嘧啶水平在截肢后和随后的36小时内立即下降,并在再生过程完成后恢复到正常水平。这表明一个或多个dnmt基因以及由这些基因编码的蛋白质表达增加。这些基因的突变可以阻止体细胞和干细胞的正常去分化,并损害再生过程。在蝾螈中获得了与鱼类相似的结果,证实了dnmt3a和dnmt1在胚芽中的水平高于其他细胞。
在斑马鱼中,间充质细胞增殖阶段之前,成熟成骨细胞去分化,转化成成骨前体,为新形成的骨结构提供来源。骨钙素(一种骨Gla蛋白,是成熟成骨细胞的标志)的浓度在24小时损伤部位显著降低,在48小时的鳍段显著降低。相比之下,哺乳动物的间充质干细胞可以产生成骨细胞,而成骨细胞又可以大量合成骨钙素。因为乌骨木是四肢的组成部分,这可能是人类肢体再生的限制因素之一。
在去分化过程中,细胞核和细胞质都会发生变化,导致新的蛋白质的合成和不再需要的蛋白质自噬降解。当胚芽形成时,自噬水平较高,自噬失活导致细胞凋亡。根据一些报道,斑马鱼经自噬抑制剂巴菲霉素处理后,与对照组相比尾部长度缩短。巴菲霉素并不是唯一抑制自噬激活的抗生素。负调控自噬的药物包括氯喹。
为了启动异形再生,必须显著增加正常有丝分裂细胞的增殖,并重新激活负责胚胎发育的基因。其中一个靶基因fam53b/simplet (smp)在远端间充质中高表达,导致了再生早期阶段的快速增殖。在再生生长的过程,促进再生组织的生长。该基因的暂时阻滞导致细胞数量减少,不能恢复尾鳍的原始结构。
在24小时smp表达受到抑制,组成胚芽的细胞分裂为远端胚芽,表达msxb、msxc和slg1,增殖缓慢,有丝分裂G2期一般长于6小时,近端胚芽,表达mps1、hsp60和pcna,增殖迅速。远端胚芽的标记基因,如slyl1和msxc,不导致细胞增殖,但支持组织内细胞数量的稳态;而mps1,一种有丝分裂丝氨酸/苏氨酸蛋白激酶,影响受控细胞分裂。当新产生的细胞迁移到新的位置、分化并取代切除的射线时,远端芽基对近端芽基起着关键作用。
在鳍状结构中,由于放线菌先于鳞毛菌形成,因此负责胶原蛋白生成的基因表达是重要的。放线菌由弹性素构成,作为皮肤褶皱的骨骼支持和间充质细胞向损伤部位迁移的基质。所有的胶原成分由col1a1a, col1a1b, col1a2基因和II型胶原编码。非胶原成分是由肌动蛋白基因家族编码的。斑马鱼是硬骨鱼的代表,象鲨是软骨鱼的一种,它们具有形成actinotrichia所需的特殊蛋白actinodin 1 (And1)和actinodin 2 (And2)。对斑马鱼胚胎中And1和And2基因的双敲除导致了放线菌的缺失,从而导致了鳍的从头形成。
除了尾鳍鳍条的正常再生外,重要的是建立鳍的初始大小,它必须与总体长成比例增长。这种调节受钙调神经磷酸酶(也称为PP2B)的控制,钙调神经磷酸酶是一种负责生长的蛋白质磷酸酶。抑制剂FK506和环孢素A抑制钙调磷酸酶后,尾鳍出现过度再生生长。
再生的持续时间已被证明依赖于切断结构的长度。近端切除比远端切除再生的时间更长。不管它们在背/腹轴上的位置如何,所有的鳍条都以相同的速度再生,结束是结构和功能再生尾鳍的完成(如图5)。
四、影响鳍再生的因素
鳍的再生与生物体内发生的任何过程一样,都取决于许多环境因素,在计划实验时必须考虑到这些因素。压力是影响炎症、再生和免疫反应等过程的关键因素之一,产生焦虑和抑郁,从而抑制生理功能。在脊椎动物中,糖皮质激素血浆水平升高被认为是应激的表现。应激源激活下丘脑/垂体/肾间轴,通过糖皮质激素受体,如应激激素和热休克蛋白的产生,导致多种生理过程的调节。代谢变化增加血糖原水平和减少组织糖原,启动免疫系统激活和渗透调节变化。应激鱼可能通过生理变化或行为,如攻击、运动减少和进食行为的改变来检测。
由化学、生理或心理应激因素引起的急性或慢性应激,如温度、高饲养密度、饮食、化学制剂、捕食者的出现、新坦克以及捕获和处理,都会增加全身皮质醇的浓度。短期压力可以增强免疫过程;而长期的慢性压力会抑制再生过程。已证实,高糖皮质激素水平会引发代谢功能障碍、组织降解和程序性细胞死亡。
温度:
温度是斑马鱼生理状态和行为的重要调节因子。为了超大限度地提高生长、采食量、饲料转化率和胃排空,保持一致的水温是很重要的。据报道,斑马鱼胚胎的温度是27℃,22 ℃和32 ℃代表正常生长和发育的下限和上限。在一项短期暴露于两种极端温度之一的研究中,胚胎在常温下被培养到成熟。根据游泳性能测试,由于负责游泳和主动运动的肌肉纤维组成的不同,两组极端人群的热敏感性都降低了。从胚胎和早期生活阶段所处的热环境转移到不适应的温度环境会引起慢性应激,这将对组织和器官的再生产生负面影响。
在允许(25℃)和限制(33℃)温度下的再生研究中,在8天时较高温度下再生率达到60%,而在25℃,在第15天达到这一点。
其他作者证明,鱼恒温处于37℃1小时皮质醇浓度是对照组的10-40倍。即使是短暂地将鱼暴露在极高的温度下也可能导致死亡。虽然单一的急性应激没有被证明会严重影响再生,但重复应激显著降低了截肢结构的完全再生。在定期的热休克导致心肌损伤后,只有25%的鱼成功替换了胶原组织并再生了损伤部位。
饮食:
自噬被认为是维持细胞内稳态的关键机制。它诱导去除聚集和错误折叠的蛋白质;核糖体、线粒体等细胞器受损;防止坏死;规范细胞废物和非必需元素的回收。在斑马鱼中,正常功能的自噬对于维持干细胞的再生能力很重要。基因突变、基因敲除或敲除或化学或药物抑制自噬的鱼类,表现出细胞死亡水平增加,以及去分化和胚芽增殖的抑制,损害尾鳍再生。
短期饥饿会迅速激活自噬反应,进而参与ATP的产生和蛋白质的从头合成。许多种类的鱼可以忍受在迁徙、季节变化、产卵期、缺氧和缺水以及温度波动期间食物的缺乏。一段时间的食物剥夺不一定会对身体活动或细胞过程产生负面影响,但会加速其关键阶段的再生。
饮食和饲料补充剂:
不同的商业饲料对生长、性成熟年龄、生育力、活力和再生有不同的影响。对于正常的斑马鱼组织再生,必须使用氨基酸、脂肪酸、维生素、碳水化合物和矿物质的比例的饲料,并建立一个适当的喂养制度。
从细菌、真菌、酵母、藻类或植物中提取的多糖1,3 - 1,6 - β-葡聚糖已被评价为斑马鱼的饲料补充剂。补充剂量0.35g 1,3 - 1,6 - β-葡聚糖饲养14天与降低死亡率和增加尾鳍再生面积有关。1,3 - 1,6 - β-葡聚糖被称为免疫系统调节剂,通过不同途径增强免疫反应。虽然硬骨鱼中尚未确定具体的1,3 - 1,6 - β-葡聚糖靶点,但哺乳动物c型凝集素受体家族的同源物被认为负责巨噬细胞的活化。一些β-葡聚糖受体的候选基因已经在鲤鱼巨噬细胞中被鉴定。类似的研究表明,由于刺激体液和细胞过程,它们诱导免疫抵抗细菌和病毒的入侵。在鲤鱼、鳟鱼和鲑鱼中,含有β-葡聚糖的食品添加剂通过激活巨噬细胞来保护免疫系统。维生素A (RA)是一种重要的信号分子。以浓度为2、4、8 IU/mL的维生素A处理Oreochromis niloticus,没有发现改善再生的迹象。然而,RA影响了再生鳍的形态:与对照组相比,治疗组再生的射线节数更高,维生素A抑制骨节之间结缔组织的生长,导致相邻射线的融合。新生的一条鳍条通常分为两条子鳍条。RA是维生素A的代谢物,在浓度为10-6M的二甲基亚砜(DMSO)中溶解,暴露在水中的鱼,这些子射线融合成一条射线。
维生素C、抗坏血酸,参与多种酶反应,是一种强大的抗氧化剂。维生素C可以保护身体免受自由基和氧化应激,消耗ROS。斑马鱼和人类一样,不能产生这种维生素,必须从饮食中获取。在维生素C缺乏的情况下,鱼类经历氧化应激,嘌呤核苷酸循环中的代谢物水平增加,导致细胞能量代谢的改变。经历严重氧化应激的鱼类在肝脏、大脑、肌肉、肠道和其他重要器官的功能上表现出严重的异常,没有这些异常,再生就无法顺利进行。
过量饲喂:
与之前发表的文章相反,一些作者报告称,持续几周的过度喂养和高脂肪饮食不会导致体重差异,但斑马鱼的认知功能受损,可能与人类的认知障碍不相上下。与摄入3.79千卡/克热量的鱼类相比,摄入4.90千卡/克热量的鱼类在端脑(负责回忆信息的大脑区域)的97个基因表达较低。这可能会对再生产生长期的负面影响,因为有效的再生依赖于维持正常生理和生物功能活力的能力,而这种能力是由大脑支持的。研究显示,过度喂食会以一种性别特异性的方式改变斑马鱼的肠道微生物群,这可能与肥胖和相关疾病有关。
过度喂养已被证明会影响成骨,这是鳍再生的一个主要因素,是斑马鱼鳍条形成的必要因素。高脂肪饮食已被证明会改变斑马鱼的血糖和胰岛素浓度,使体重增加23%,并导致鳞片边缘被吸收,这表明骨矿化失败。抗酒石酸酸性磷酸酶的活性,一种破骨酶,显示增加,而碱性磷酸酶,引发骨矿化,减少了食用高脂肪饮食的鱼类。这种不平衡导致骨质疏松和骨形成受损。
放养密度:
虽然斑马鱼作为一种模式生物的重要性正在增加,但其养殖的放养密度仍未确定。一些研究报告,密度为12-15尾鱼/升曝气水。人口过剩不仅对再生产生负面影响,而且会抑制所有的生理过程。据报道,斑马鱼对拥挤(>10鱼/0.25L)敏感,作为一种生物应激源。在一项关于鱼类应激的研究中,拥挤状态下的全身皮质醇浓度是热休克状态下的两倍,接近每克80 ng鱼。只有33%暴露在拥挤环境中的鱼成功地再生了心肌。在类似的研究中,将鱼在40尾鱼/L的密度下保持3小时诱导急性应激,5天诱导慢性应激。在这两种鱼类中,整个身体的皮质醇浓度大约是对照组维持在0.25尾鱼/升的四倍。虽然斑马鱼是高度群居的物种,但0.13、0.30和1.2尾鱼/L的低饲养密度与水箱水中溶解的皮质醇浓度没有显著差异。
水族馆设备:
水族设备在细胞增殖过程中发挥了重要作用。作者测量了将斑马鱼分别放在充满砾石和人工植物的水族箱中,或在贫瘠的水族箱中进行活跃分裂的神经元数量。与那些在没有水的罐子里的鱼相比,在富水的罐子里的鱼的皮质醇水平略有升高。这可能会对细胞增殖产生负面影响,但短期暴露在含有不熟悉元素的新环境中(6分钟和30分钟)不仅会激活应激反应,还会对大脑的再生过程产生刺激作用。环境的改变可能会改变鱼类的移动能力、食物摄取能力和鱼群学习能力,进而影响再生。并没有导致鱼类行为或皮质醇水平的差异。
化学药剂:
化学制剂,如咖啡因,尼古丁,乙醇和可卡因,添加到水箱可能是抑制剂或促进再生。咖啡因会增加心率,加速氧气输送到组织和器官,这可能会影响再生。本研究介绍了在咖啡因影响下鱼类的行为评估结果。暴露在咖啡因下的斑马鱼在水箱底部待的时间更长,表明它很焦虑。应激行为意味着机体反应受到抑制,从而导致再生迟缓。为了分析咖啡因的影响,斑马鱼被暴露在浓度为0.5-150 mg /L的咖啡因中60分钟。浓度大于50 mg/L时,鱼游的距离较浓度为0 ~ 25 mg/L时降低。暴露于浓度大于50 mg/L的咖啡因会增加冷冻行为和在罐底停留的时间。
在许多动物中,白细胞被细胞因子和ROS等促炎物质吸引到损伤部位。在尾鳍截肢后立即产生ROS,在20分钟后达到峰值浓度。过氧化氢浓度已被确定为白细胞聚集到伤口的关键介质。近来的研究表明,广泛应用于抗菌伤口敷料等生物医学应用的银纳米颗粒抑制了斑马鱼的再生过程。伤口愈合过程的损伤是阶段性的,影响伤口上皮化和早期胚芽的形成。据报道,银纳米颗粒处理可导致18 - 36小时期间ROS生成减少,并显著增加聚集的中性粒细胞数量。活性氮(RNS)是另一组炎症介质。亚硝酸盐和一氧化氮对斑马鱼再生的研究表明,在缺氧条件下,RNS是中性粒细胞适当补充到损伤部位所必需的。亚硝酸盐处理冷冻损伤的心脏组织可促进心肌细胞增殖和血管生成。
糖皮质激素泼尼松龙会影响斑马鱼的骨形成和成骨细胞分化,并增加再生时间。糖皮质激素治疗改变再生组织的蛋白表达模式。泼尼松龙暴露尤其影响参与溶酶体酸化的转运体的表达,以及那些参与囊泡运输和分泌的转运体。因此,钙转运atp酶也过表达,导致骨矿化改变。
五、结论
这只是再生医学中斑马鱼研究的开始。本文并没有对尾鳍再生的各个方面进行全面的综述,但对尾鳍再生的调控机制仍有很多未知。在计划实验时,必须考虑促进或抑制组织再生的多种环境因素。
参考资料:
[1] Engeszer RE, Patterson LB, Rao AA, Parichy DM. Zebrafifish in the wild: a review of natural history and newnotes from the fifield. Zebrafifish 2007;4:21–40.2.
[2] Kimmel CB, Ballard WW, Kimmel SR, Ullmann B,Schilling TF. Stages of embryonic development of thezebrafifish. Dev Dyn 1995;203:253–310.3.
[3] Gonza´lez-Rosa JM, Burns CE, Burns CG. Zebrafifish heartregeneration: 15 years of discoveries. Regeneration (Oxf )2017;4:105–123.4.
[4] Gemberling M, Bailey TJ, Hyde DR, Poss KD. The zebrafifish as a model for complex tissue regeneration. TrendsGenet 2013;29:611–620.
文丨Lina Lebedeva,Beibitgul Zhumabayeva, Tatyana Gebauer, Ilya Kisselev and Zaure Aitasheva
翻译丨马雪梅
DOI: 10.1089/zeb.2020.1926