
NEWS
新闻中心
SERVERS
服务项目
发布时间:2021-03-03
核心摘要
为详细了解神经网络的功能以及动态血管系统如何支持神经网络,需要在厚组织中研究其快速三维成像过程。在这里,我们介绍了共聚焦光场显微镜,它能够展示大脑内部神经快速成像。它采用广义的共聚焦检测方法,选择性地汇集共焦系统的荧光信号,并提供光学切片能力,以提高厚组织的成像分辨率和灵敏度。
我们演示了自由游动的斑马鱼幼鱼脑中钙瞬间变化的过程,并在捕获猎物期间观察单个神经元的相关行为活动。此外,在小鼠大脑中,我们检测到深度为370μm的神经活动,并以70Hz直径跟踪到800μm×厚度150μm和深度为600μm的血细胞。
文丨Zhenkun Zhang, Lu Bai1, Lin Cong, Peng Yu, Tianlei Zhang, Wanzhuo Shi, Funing Li, Jiulin Du and Kai Wang
发表于《Nature Biotechnology》2020年8月。翻译丨叶婷

一、综述
大脑通过召集具有多种功能的大型细胞集合并及时准确地协调它们来执行复杂的功能。为更好地了解这些过程,需要使用工具来获取相关细胞在生物学及其原始环境中的动态空间变化。用于脑部内成像的传统工具,例如共聚焦显微镜和双光子扫描显微镜,都是基于点扫描方案,对于研究快速的体积动力学而言太慢了。
因此,引入了许多更快的成像方法,包括新的扫描机制,空间和时间多路复用,以及对稀少样品的利用。但是,荧光饱和度和动物对激光功率的耐受程度仍然限制了可实现的成像通量。光片显微镜和广角聚焦双光子显微镜可以并进行横向图像采集,可对小型动物进行高通量地高速成像(如秀丽隐杆线虫和斑马鱼幼鱼)。但是,获取哺乳动物大脑深处较佳成像图,仍然是一个挑战。
光场显微镜(LFM)通过单帧相机捕获整个观察对象不同入射深度的信号混合物,然后通过三维(3D)反卷积计算分离混合信息,从而完全实现了荧光采集的平行化。因此,这种方法可以在三维立体结构实现极快的动态成像,但是由于LFM在空间分辨率和成像体积的轴向范围之间存在固有的限制,所以空间分辨率会降低。
同时,轴向覆盖范围之外的信号可能通过增加背景信号并因此增加了相关的散粒噪声,极大地干扰了对焦信号。谈及光学切片功能的缺失,可降低常规LFM中的信噪比(SNR),与传统LFMs相比会降低3D重建的质量。
因此,优化受样本厚度限制的轴向覆盖,以实现所需的空间分辨率、信噪比和重建质量是非常具有挑战性的,特别是对于厚组织(例如大脑)来说。因此,将光学切片功能引入LFM是使其获得更广泛应用的关键。
为此,已经从侧面证明了在较小体积中荧光可以选择性平面激发,但是由于几何约束,这种光学构造无法应用于哺乳动物的大脑或任何自由移动的动物。LFM结合了广角聚焦和多光子的同时重斑激发的功能,但它们需要很高的激光功率,并且还无法形成高速3D成像。LFM中还应用了具有光斑照明功能可将背景忽视,但由于需要额外的成像而降低了速度,并且无法通过程序删除背景的散粒噪声以提高SNR。
LFMs成像系统中,特殊算法也开发出来以提取老鼠大脑发出的神经信号,但是它们仍然非常容易受到强烈的背景感应和散粒噪声的影响,而且通常不适用于捕获涉及快速结构变化的像。
在这里,我们提出了一种新型的LFM,称为共聚焦LFM,可以在大脑深处实现无背景的快速体成像。共聚焦LFM配备了一种新的广义共聚焦检测方案,可确保从激光器中选择性和高效地收集信号,这与传统的共聚焦检测设计大不相同,后者仅从一个成像平面提取信号。这种背景的消除功能,也称为光学切片功能,可以保持较高的SNR,并减少对厚组织成像时的重建伪影。
为了证明该方法的实用功能,我们报告了几个示例应用程序的结果,包括自由移动斑马鱼幼体的无模糊全脑成像,直径为⌀800μm,高度为200μm的圆柱状成像情况,对处于清醒状态的老鼠大脑中神经元群体的钙成像具有显着改善的信噪比(SBR),并且可以在清醒的老鼠大脑中以600μm的深度和70Hz的频率捕获循环血细胞。结合光学切片功能、泛光照明配置和高速度成像的共聚焦LFM,可以大大有益于关于清醒的大脑和其他类型的厚组织的快速体积动力学的各种研究。
二、研究成果:
1、共聚焦光场显微镜
共焦LFM在我们先前报道的另外的LFM(XLFM)中使用了相同的光学设计,它与自适应光学显微镜中的Shack-Hartmann波前传感器密切相关,并在物镜的共轭光瞳面上放置了微透镜阵列。这种配置消除了传统LFM中焦平面附近的重建伪影。
与使用传统LFM广角照明不同,在共聚焦LFM中,我们激发光束,该光束通过一个平面并穿过专门设计的光罩中心的细缝,并与微透镜和物镜针孔中心对准。然后有选择地照亮物镜下方的轴向样本平面(x–z平面)(图1a)。由中心微透镜形成的荧光图像通过模上相同的狭缝进行过滤,然后共轭到成像相机(图1a)。为了覆盖整个空间,通过检流镜(图1a中的G2)在y方向上扫描激发光片。同时,安装在可旋转平台上的膜同步移动,以使激发光束在整个扫描期间始终穿过光罩上的中央缝隙。
这样,扫描激发光片,扫描膜上的中央狭缝,中央微透镜和物镜一起作为低数值孔径(NA)进行线共聚焦显微镜扫描工作。除了中央微透镜之外,阵列中的其他微透镜也从成像物镜的共轭针孔上不同位置收集荧光信号,并且每个都在膜的不同位置形成了子图像。在每个子图像中,来自不同深度的信号在膜上进行了分散。同时在扫描膜上特别设计了的多个孔,以使它们能让子图像中不同深度范围内的信号通过(图1a)。然后将所有经过膜过滤的子图像都成像到成像相机上,该成像相机会在当前膜的扫描过程中保持曝光。在每次扫描结束时,相机会读取具有足够信息的二维原始图像,以供以后进行3D重建。
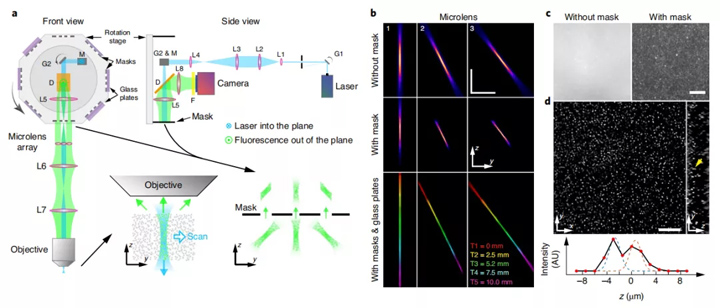
图1:共焦LFM的设计与特点。a,光学系统的概述和放大图。L1-L8,消色差透镜;D,短二向色镜;G1和G2,扫描振镜和M镜。放大的视图是样品平面(底部中间)中的垂直扫描光片,其由微透镜阵列形成的图像被共焦掩模在空间上过滤(底部右下)。b,实验测量的投影图来自具有和不具有掩模和玻璃板的三个示例微透镜的PSF。不同厚度(0、2.5、5.2、7.5和10mm)的玻璃板将其PSF(红色,黄色,绿色,青色和品红色)移动到不同的z位置以连续覆盖更大的轴向范围。c,原始图像的放大视图当对嵌入3D琼脂糖中的荧光珠进行成像时,带和不带掩模的LFM中收集到的光。d,3D重建体中,荧光珠在单个平面上的的典型图像。黄色箭头表示两个在轴向上紧密间隔的荧光珠。黄色箭头表示两个在轴向上紧密间隔的荧光珠,并通过两个高斯函数拟合,表明荧光珠预估间距离为3.4μm。比例尺,50μm。
这种共聚焦检测方案非常有效,因为它不会从激发点对准的光束中丢弃任何荧光,但是几乎可以阻挡所有除激发点对准外的背景。 它也可以高速运行。相机的帧速率而不是激发光束和膜的扫描速率限制了物体成像的速度。
为了扩展共焦LFM的能力以在较大的轴向范围内提供空间分辨率,我们开发了一种快速的远程聚焦机制,可以在多个离散的轴向位置之间快速切换成像量。这是通过在膜和微透镜阵列之间插入一系列不同厚度的玻璃板来实现的(图1a)。 我们可以通过仔细选择这些玻璃板的参数,通过在每个扫描中捕获的多个较浅的区域相连来覆盖更大的体积。
我们通过嵌入在琼脂糖凝胶中的荧光珠的成像来表征共聚焦LFM。在一个共聚焦LFM施用中,该系统对每个微透镜的有效NA为0.13,并且在45μm轴向范围内可实现2μm的横向空间分辨率(图1b)。可以在五个不同的轴向位置进行光栅扫描,以覆盖⌀800μm×200μm的结构(图1b)。我们通过测量点扩散函数(PSF)的大值的全宽来确定横向分辨率的范围,约为2.1μm。轴向分辨率极限由通过层微透镜测得的PSF的横向尺寸和倾斜角确定,约为2.5μm。通过校正系统像差,我们可以通过重建成像体实现衍射受限的现象。所有这些成像性能都可以再共焦LFM保留,而传统LFM则不能,因为在对较厚的样品进行光学成像时,会产生压巨大的背景噪声(图1c)。我们进一步证实,本系统至少可以清楚地分辨出较厚样品中轴向方向上相距3.4μm的两个荧光珠(图1d)。
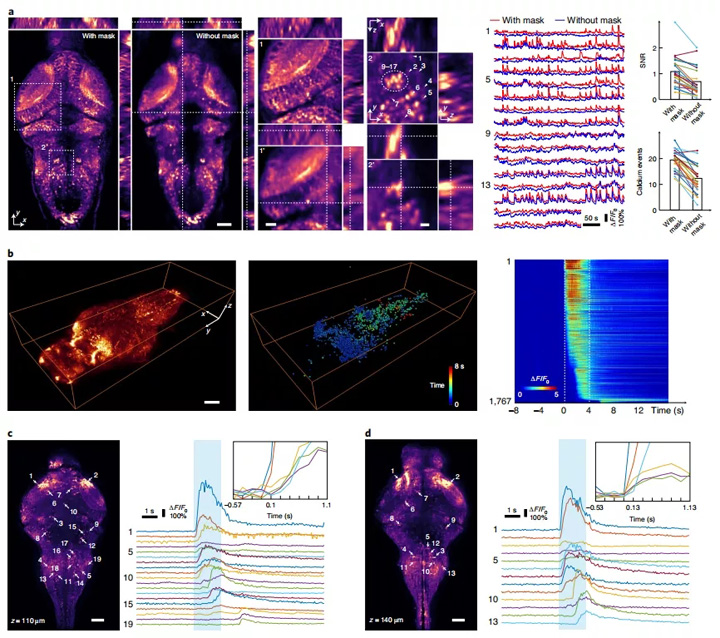
图2:运动受限斑马鱼幼鱼神经活动的全脑功能成像。a,左图,对斑马鱼幼鱼脑中的自发神经活动进行成像时,由共聚焦和非共聚焦LFM获得的重建体中代表性平面的强度投影(MIP)。左边的中间放大图表示的是左侧平面正方形虚线位置的典型图,虚线表示x-z和y-z横截面视图的切片位置。右图显示了共聚焦和非共聚焦LFM对钙瞬变的捕获情况(显示24个中的16个;红色,有掩模;蓝色,无掩模), 2和2'区显示了SNR和被激活神经元上识别的钙离子数量(一尾斑马鱼中有 24个细胞)。条形图表示数据平均值。比例尺分别为50、20和10μm。b,当施加光刺激时,共聚焦LFM在整个斑马鱼幼鱼脑中捕获的钙信号MIP随时间的变化(左);在光刺激下激活的神经结构在其相应位置被渲染为小球,并根据其开始时间进行着色(中间)。这些神经结构的神经活动按其激发时间排序(右)。0到4 s处的虚线表示光刺激的开始和结束。比例尺,100μm。 c,z = 110μm处的代表性神经结构(左)及其荧光强度迹线(右)。按照反应开始时间的顺序标记它们。前六个神经结构的荧光信号的放大图(右上方)。比例尺,50μm。 d,z = 140μm处的代表性神经结构(左)及其荧光强度迹线(右)。按照反应开始时间的顺序标记它们。前六个神经结构的荧光信号的放大图(右上方)。比例尺,50 μm。
以高分辨率对整个斑马鱼幼鱼大脑的神经活动进行成像。为了举例说明共聚焦LFM在实际生物样品中的成像性能,我们对运动受限的斑马鱼幼鱼整个大脑进行了钙活动的功能成像。受所用相机(5,120×3,840像素)的30Hz帧速率的限制,我们可以6Hz在的斑马鱼大脑中形成⌀800μm×200μm的像(6,700万有效像素)。
背景的消除具有两个关键优点:
提高了钙活度检测的灵敏度和减少重建伪影。在传统的LFM中,细胞的可检测钙活性受到周围细胞荧光发出的散粒噪声的限制,因为LFM会捕获沿不同方向并整合所有荧光的投影视图。尽管各种计算方法都可以从背景中提取激发光束,但高背景仍然会导致高散粒噪声39。鉴于斑马鱼幼鱼头部的厚度为300μm,在这种共聚焦LFM施用过程中,轴向覆盖范围减小了45μm,从而使SNR增加了 ≈ 2.6倍。
更重要的是,如果从有效较小的体积中捕获到有限数量的投影视图,则体积重建算法将收敛到更准确的解决方案。这些效果可以清楚地显示在图2a中,其中在进行和不进行共焦检测的情况下,在67毫秒的时间间隔内,LFM依次捕获了两次钙自发活动。与传统LFM相比,共聚焦LFM产生的图像更清晰,空间细节更精细。共聚焦LFM中不存在常规LFM中可检测到的重建伪影,例如靠近视神经顶盖,后脑和中心线的几个黑暗区域(图2a)。
两种方法都可以检测到明亮的神经元,但是仅在共聚焦LFM中才能检测到微弱的神经元及其钙活性。与传统的LFM相比,共聚焦LFM更容易区分密集的神经元(图2a中的神经元9-17)。我们对图2a中区域2和2'中所有激活的神经元的SNR进行了量化。共聚焦LFM将信噪比提高1.6倍,平均状态下检测到钙活动增加了60%(图2a)。
高成像速度可用于识别整个环线中神经激活的顺序。为了说明这一点,我们用闪光灯刺激了受限的斑马鱼幼鱼,观察到了大量的神经元,从视神经上皮开始到后脑先后被强烈激活。 我们提取了在光刺激下激活的1,767个神经结构,发现它们在空间上不会发生重叠(图2b),同时也量化了神经元开始激活的时间顺序(图2b–d)。
与以往报道使用的常规LFM的结果相比,共聚焦LFM通过降低成像速度实现了更高的分辨率和信噪比,通过五个亚体成像以覆盖整个斑马鱼幼鱼大脑。然而,虽然降低成像速度但仍能捕获钙瞬变,而且更高分辨率和信噪比能提供了更多的结构信息来确定神经元身份,并提高了灵敏度能检测更弱的神经。
2、自由游动斑马鱼幼鱼神经活动的全脑功能成像
高速形体成像和高密度照明配置使LFM成为捕获自由移动动物快速成像的较好装置,这在神经科学领域具有重要意义。大量的研究中,在相对较小的空间和时间分辨率下记录了在斑马鱼幼鱼在捕获猎物行为期间神经元组的神经活动。
为了证明共聚焦LFM在自由移动的动物中的成像性能得到改善,我们还将其与高速3D跟踪系统相结合(图3a),以斑马鱼幼鱼在捕获猎物行为期间对整个大脑的神经活动进行成像。为了避免运动引起的图像模糊,我们在每帧4毫秒内完成了扫描和照相机曝光,读取时间为33毫秒(照相机帧频为30Hz)。
尽管斑马鱼可以自由移动,但是其前庭和视觉系统不可避免地分别受到跟踪器和激光束照射的影响。幸运的是,斑马鱼幼鱼在适应这种环境后仍然能够捕获猎物。在一个示例性的猎物捕获案例中(图3b,c),斑马鱼幼鱼在约15.03 s时以其眼睛收敛和尾巴J型弯曲45行为发起了猎物的捕获。
由图3c知在15.72 s左右成功吃了由红色箭头指示的草履虫。可以清楚地观察到成功捕获猎物后斑马鱼大脑几个区域和孤立神经元的被激活(图3d,e)。该结果与先前的观察结果非常吻合26,但提供了更高的分辨率和灵敏度。
例如,可以清楚地识别出后脑中几个孤立的神经元的激活;小脑附近的两个不同的神经元组可以很好地区分;在成功捕获猎物的过程中只有位于脑后方的一组神经元被明显激活。几个区域的神经被激活了,包括背侧视神经皮层的神经纤维网(图3e中的箭头1所示),小脑附近的单个神经元(图3e中的箭头2所示)和视神经顶盖前部的一个小区域(图3e中的箭头4所示)在整个斑马鱼捕获猎物过程中均能得到识别和追踪(图3f)。
为了消除运动引起的信号波动,计算了目标活跃区域与手动选择的非活跃区域之间的强度比,以作为神经激活的证据。此外,通过分析记录在三尾斑马鱼幼鱼上的六种表现,确认当捕获猎物时两个大脑区域具有强烈反应(图3g,h)。这些示例表明,共聚焦LFM可以很好地用于自然状态下斑马鱼幼鱼整个大脑的成像技术,并大大提高了空间分辨率和信号检测灵敏度。
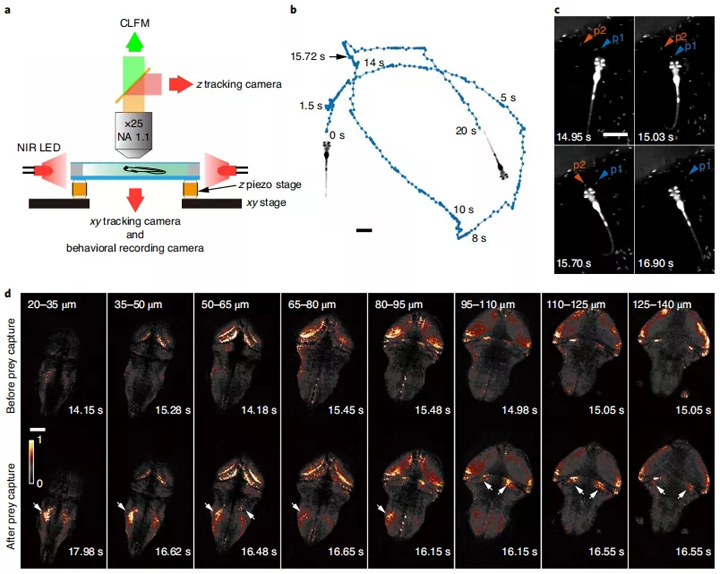
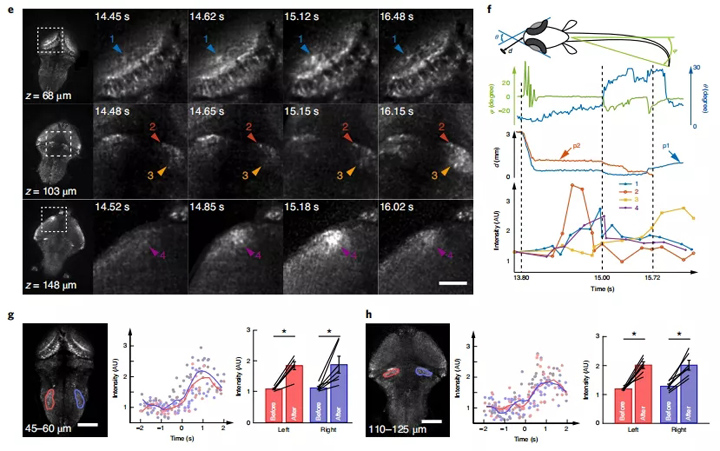
图3:对斑马鱼幼鱼捕食行为期间的全脑神经活动进行成像和跟踪。a,用近红外LED,近红外发光二极管简化的跟踪和成像系统原理图。b,跟踪和成像过程中幼虫斑马鱼的游泳轨迹。在15.72 s草履虫被成功捕获。比例尺,2 mm。c,斑马鱼幼鱼在猎物捕获期间行为记录的代表性帧。箭头指示两个相关联的草履虫。比例尺,2 mm。d,在成功捕获草履虫前后的代表性时间点上,指定轴向范围内MIP图像的比较。激活的神经元和区域由箭头指示。神经元用GCaMP6s标记,比例尺为100μm。e,斑马鱼幼鱼捕获猎物期间几个大脑区域的神经活动的放大视图。箭头2表示单个激活的神经元。比例尺,50μm。f,展示了斑马鱼在捕获猎物的过程中四个选定区域和e图中的由GCaMP6s荧光标记的神经元在行为特征和神经动力学的变化情况。θ,d和φ分别代表斑马鱼眼睛的会聚角,草履虫和斑马鱼嘴之间的距离以及斑马鱼尾巴的弯曲角度。为了消除运动引起的荧光信号变化,计算了目标区域及其相关区域之间的荧光信号比率(方法)。这种测量并不是神经激活强度的精确量化,但可以作为神经激活的证据。P1和P2是c中的草履虫1和2。g,h,在捕获猎物时,大脑中两个区域的神经活动。左,为ROI。中间为在ROI中测得到荧光信号与猎物的摄入量一致(0s)。分散的光点代表所有试验中两个ROI的标准化荧光强度。痕迹是所有试验的平均钙信号,并用0.2秒的时间窗平滑。右边条形图显示了在2秒的时间内,猎物摄食前后GCaMP6s的平均荧光强度。比例尺,100μm.g,左侧区域,P = 0.0156;右侧区域,P = 0.0156; h,左侧区域,P = 0.0156;右侧区域,P = 0.0156;n = 3尾幼鱼,六个试验)。 * P <0.05(单尾),Wilcoxon签署秩检验。数据以平均值±标准误差表示。
3、在背景减少的条件下对小鼠脑中的不同区域神经活动成像研究。
为了进一步证明共聚焦LFM在脑成像中的应用,我们记录了清醒小鼠大脑中神经元活动。用传统的LFM对不同区域神经进行成像具有挑战性,因为在散射中留下来并有助于成像的弹道光呈指数级下降。
同时,随着成像深度的增加,聚焦范围之外的成像会严重受损。为了更好地区分融入在LFM高背景中的神经活动,不同计算策略已经被开发出来用以探究激活的神经元的时空组合特征。在这里,我们表明了共聚焦LFM可以通过物理排斥背景噪声并提高检测神经活动的灵敏度来改善原始数据中的SBR。这种物理策略既与各种计算方法兼容,又对各种计算方法有益,大大改进的LFM平台能对厚组织进行快速体积成像。
为了在小鼠大脑中实现成像性能和速度的组合,我们构建了另一种共聚焦LFM,其空间分辨率为⌀800μm×150μm(分辨率为4×4×6.4μm3)。与用于斑马鱼成像的共聚焦LFM不同,后者在旋转平台上扫描锁模,该共聚焦LFM使锁模保持不变,并在一定深度成像。在微透镜阵列和成像物镜之间的放置一个振镜对激发滤光片进行扫描,使其覆盖一定范围,并停止了荧光的继续扫描,以使其能够穿过激光针孔。置于探测针孔和相机之间的另一个检流镜重新扫描了荧光,形成了光场图像。
我们在清醒的小鼠的初级视觉皮层中探究钙信号成像,并进行了逐帧无偏体积重建,以获得灵活的数据处理和神经活动提取。三个成像体在不断增加的深度聚焦,以覆盖从皮质表面到400μm深的轴向范围。如图4a所示,常规LFM和共聚焦LFM都可以在小鼠皮层表面对标记的密集神经元进行成像,但是在抑制背景方面共聚焦LFM表现更好,在成像深度增加时发现了较弱的活化神经元(图4a)。
为了量化共聚焦LFM中SBR的改善情况,我们使用重建原始图像的低空间频率分量来估算背景值50,信号使用的钙离子的活性峰值时不同深度的20个神经元。如图4b所示,当成像深度从50增至110μm时,SBR值增加,更多活化的神经元开始出现。此后,随着成像深度的增加,组织中的散射使荧光信号呈指数衰减,SBR开始下降。在深度大于300μm时,由于小鼠皮层第4层神经元标记减少,以及组织散射的增加,被识别的神经元数量显著减少。在整个深度范围内,共聚焦LFM的性能均优于传统LFM,并且在300μm处的SBR大约增加了三倍。
同样,当轴向覆盖率不同时,共聚焦LFM在相同深度提供不同的SBR。例如,图4b中的共聚焦2和共聚焦3代表两个体积成像,分别为150-300和250-400μm的不同轴向覆盖率。在深度为290μm处共聚焦3比共聚焦2具有更好的SBR,因为290μm以上的神经突起的背景噪声比其下方的强得多。该示例表明,背景噪声是厚组织功能成像的主要限制因素,并且所提出的共聚焦检测方案可以有效地抑制LFM成像时产生的噪声。
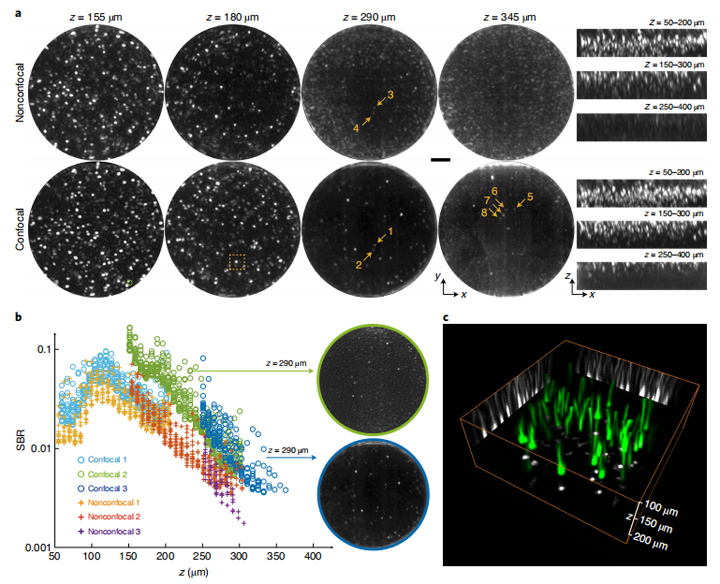
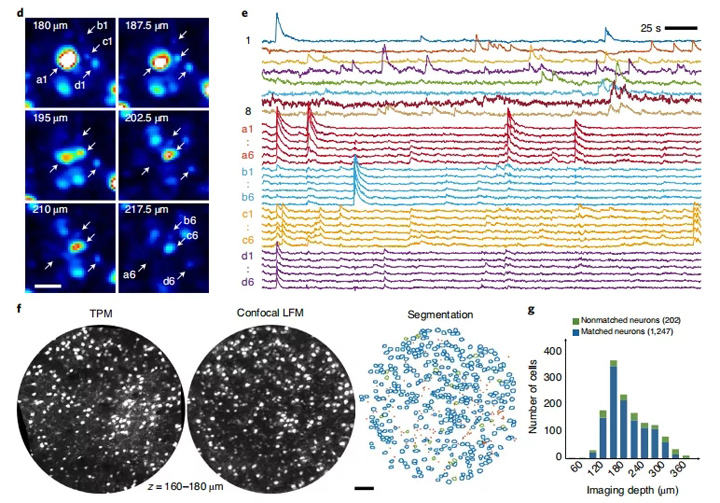
图4:清醒小鼠大脑中神经体活动的功能成像。a,在具有GCaMP6s标记的小鼠皮质中,在代表性深度处通过非共聚焦和共聚焦LFM获得的成像结果比较。显示的图像是背景减去荧光图像(方法)随时间的标准偏差。XY视图是在指定的z深度处的成像结果。x–z视图是覆盖轴向范围的三个成像体的MIP。比例尺,100μm。b,在不同深度的共聚焦和非共焦LFM中实验测量的SBR。用共聚焦和非共焦LFM在不同深度进行了实验,共焦1-3和非共焦1-3表明六项不同的成像试验。每个数据点代表在一个人工确认的神经元上测量的SBR。在共聚焦和非共焦情况下,将在每个深度绘制前20个的神经元。带有绿色和蓝色边缘的图分别是在共聚焦2和3中以与z = 290μm处按照与a相同的方法处理的成像结果。c,CNMF-E在不同的z平面上发现,通过结合相邻和功能相关的空间足迹识别出50个神经结构。 d,在a及其相邻的z平面中指定小正方形的放大视图。a1-a6,b1-b6,c1-c6,d1-d6是来自四个不同深度的神经元的神经结构。比例尺,20μm。 e,由CNMF-E提取的d中代表性神经结构的神经活动。 f,通过TPM(左)和共焦LFM(中)获得的20μm厚的MIP图像的比较。与a中相同的方式处理通过共聚焦LFM获得的500个空间成像体。手动识别两个图像中的神经结构以进行比较(右)。蓝色圆圈表示在共聚焦LFM和TPM图像中都可以找到的神经元;绿色圆圈表示只能在TPM图像中找到的神经元。红点是在共焦LFM和TPM图像中都可以找到树突。比例尺,100μm。 g,由TPM和共聚焦LFM在不同深度成像的已识别神经元的总和。一只小鼠中n = 1,499个神经元。
高分辨率和灵敏性相结合,不仅使我们能够从激活的神经元中提取钙信号变化,而且还能够探索其结构特征,这些结构特征可能有助于确认它们的身份。
为此,我们从逐帧重建的成像体中提取了不同z平面的时间序列,并在每个z平面上使用一种先进的约束的非负矩阵分解的CNMF-E50识别了激活的神经结构的空间结构。通过在不同的z平面上合并相邻且功能相关的神经足迹,我们可以正确地检测出锥体神经元顶端树突的主干,确定其体细胞的正确位置,并将它们与通过的纤维区分开(图4c)。该方法甚至在某些密集标记的神经元区域也有效(图4d)。能很好分辨接近8μm的明亮神经元体和纤维。连续纤维的横截面可以正确提取,因为在不同深度的单个空间足迹和它们的功能迹线高度相关(图4e)。
我们还通过共聚焦LFM和双光子显微镜(TPM)成像了相同数量的神经元。尽管在两种不同的成像方式下记录的同一神经元的亮度因在不同时间成像而有所不同,但这些神经元的空间足迹高度相关(图4f)。在皮质层以下约180μm的代表性平面上,共聚焦LFM成功检测到TPM中发现的94%的神经元体(362/385)。
同时,我们确定了在该平面上共聚焦LFM和TPM均可分辨的119个神经突横截面。当成像深度为400μm时,共聚焦LFM检测到TPM中发现的神经元体的83%(1,247/1449)(图4g)。共聚焦LFM成像的神经元位于小鼠皮质层层下方370μm。
这种高速的体积成像以及共聚焦LFM中可靠地提取神经结构和活动的方法仅需要非常低的激光剂量(在整个体积成像中约为1mW);因此,持续数天且每天进行数以万计的功能记录是可行的。
4、对清醒的小鼠大脑中的循环血细胞进行成像和跟踪。
在微观尺度上捕捉循环系统的快速动态,可以帮助洞察其发展过程和疾病状态机制。已经开发出各种技术对斑马鱼幼鱼跳动的心脏进行成像,但是将这些技术扩展到大而分散的组织(如小鼠大脑)中成像的难度很大。
在这里,我们发现在清醒的小鼠大脑中深600μm处,共聚焦LFM可以同时对数千个血管分支中的快速循环血细胞进行成像,且与传统成像方法相比,其通量提高了100倍以上。
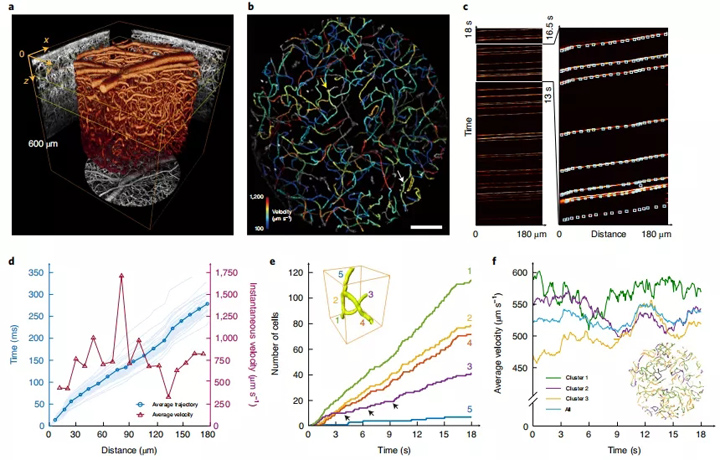
图5:清醒的小鼠大脑中的循环血细胞的成像和跟踪图。a,通过对用共聚焦LFM捕获的循环细胞随时间的平均成像体来获得血管网络的体渲染。将在六个不同深度成像的六个不同时间序列的像组合在一起,作为z轴中大于600μm的一个像。b,深度在100至250μm之间的血管网络的MIP。血管分支根据其中的血细胞的平均速度进行颜色编码。根据分支中血细胞的平均速度对分支进行颜色编码。灰色血管表示由于以下几种原因无法估算速度(方法)。比例尺,100μm。c,在b中的白色箭头指示的是一个代表性血管分支上捕获的细胞轨迹的示例。每个移动的血细胞可以被识别为沿着血管的连续的明亮轨迹。可以在时间和空间上精确跟踪它们的轨迹,如放大图中的小方框所示(右图)。d,不同的细胞轨迹在时间和空间上对齐,显示了它们之间的变化速度(浅蓝色)。这些轨迹的平均值(深蓝色)表示沿血管的行进速度不恒定。可以通过相对于时间(深红色三角形)的微分来计算沿血管的瞬时速度。一只小鼠的一根血管中含有34个细胞。e,血细胞计数通过血管不同分支的血细胞计数b中黄色箭头表示所分析的血管。图显示了其五个分支的结构。来自血管1的血细胞分布到分支2和3中,它们之间的分配比率不断变化。f,显示在深度范围100-250μm的三个不同血管的平均速度。图显示血管颜色由其血管本身决定。
我们在清醒的小鼠大脑中用深红色荧光染料标记了部分循环血细胞,并在70Hz下对其成像。由于较长波长散射较少,我们可以在小鼠皮质深达600μm处将对标记的血细胞成像(图5a)。
通过跟踪沿每个血管随时间变化的荧光信号变化,我们可以获得循环血细胞的轨迹,并在三个维度上以高时空精度跟踪它们(图5b,c)。由于随机的或有意义的生物学上过程53,例如血管耦合,血细胞运动所表现出的血液循环速度一直在变化(图5d)。
而且,血细胞可能由于其几何形状的变化而无法保持恒定的运动速度(图5d)。我们在5个成像深度从0到550μm的区域中分析了2,554个血管节段(占总血管的80.4%),并在5个试验中追踪了61,059个血细胞。将每个血管上的这些详细测量值结合起来,以提供整个成像体积内血液循环动力学的平均估计值。我们还能够研究血细胞如何在血管的不同分支上进行动态分布(图5e)。
此外,我们可以基于分支血管中的瞬时血流速度进行聚类分析,从而探索不同血管分支之间的流体动力耦合。例如,深度在100和250μm之间的血管可以分为具有不同速度曲线的三个不同的组(图5f)。事实证明这三组中的血管空间分布是混杂着的。
三、讨论
与共聚焦显微镜相似,广角显微镜在较大组织中的三维荧光成像能力也有很大提高,共聚焦LFM有效地降低了常规LFM中的背景噪声,并大大增强了大脑深处的成像的灵活性和成像的质量。这些优点不会损害其高容量成像速度。
尽管在共聚焦LFM中垂直激发光片对物体的扫描不是瞬间完成的,限制实际体积速率的是摄像机帧率,而不是扫描速度(扫描速度可以上升到千赫兹)。事实上,我们通过使扫描速度比相机帧率更快来实现更高的瞬时体积率,以避免移动引起的图像模糊。
我们展示了共聚焦LFM在自由移动的斑马鱼幼鱼中,能记录全脑神经活动的高时空分辨率成像中的潜力。由于分辨率和灵敏度的提高,我们可以识别斑马鱼幼鱼捕食过程中与行为相关的单个神经元的活动。
然而,在自由移动的斑马鱼幼鱼上,记录每一个神经元,并可靠地提取它们在很长一段时间内的活动仍然具有挑战性,因为动物的身体(包括大脑)也可能发生较大的变形,即使空间分辨率提高了,也会影响定位。如果想要可靠地提取自由移动的动物在大群体和长时间内的单个神经元活动,那么稍微降低标记密度或特定地标记某些神经元组是可行的策略。
将共聚焦LFM应用于高密度标记小鼠大脑中的钙成像可实现更优的SBR和更大的穿透深度,但代价是成像体积覆盖率降低。如XLFM26所示,这种折衷可以通过在共焦LFM中引入多焦点显微镜来避免。如果使用红色荧光指示剂,由于在较长波长下的散射减少,成像深度也可以增加。
在数据的后处理中,我们采用一帧一帧的重建策略进行无偏结构估计,并将CNMF-E分别应用于不同的z平面。这种无偏差的体积重建有助于清晰地区分细胞和经过的纤维,并显示与通过TPM获得的成像结果高度相关。重建的计算成本是可控的。重建图7和8所示的600和4,800个子体积大约需要7和27h。如图3和4所示,在配备有两个图形处理单元的软件上(补充说明1)。
如果无偏的结构信息不是关键的,为常规LFMs [28,29]所开发的几种计算方法可以很容易地应用于共聚焦LFM,以从躯体中提取神经活动,并且比常规LFM具有更好的性能。
此外,将共聚焦LFM捕捉到的密集标记神经元与TPM成像的神经元相关联,可以结合这两种成像技术的优势即速度和分辨率。例如,我们可以在通过共聚焦LFM成像的大量神经元中识别出对某些实验目的有意义的神经元,然后使用TPM以高分辨率对这些神经元的树突进行表征,以获得更详细的结构或功能信息。
我们证明了使用共聚焦LFM可以很好地跟踪循环血细胞,并且可以深入小鼠大脑深600μm。这为在复杂的三维血管网络中精确量化不同血管之间的血流动力学和耦合提供了一种独特的方法。此外,该系统可以很容易地与体积功能成像相结合,以探索神经活动与血管系统之间的耦合,这是一系列非侵入性神经成像技术的基础,对神经科学具有重要意义53,56。
尽管我们在这项工作中主要关注大脑成像,但共聚焦LFM是一种通用成像技术,可以应用于不同类型的厚组织。它提供了一种灵活的机制来调整LFM的分辨率,SNR,轴向覆盖范围和速度来改变固有设置,从而为不同亮度,密度,散射的样本实现好性能(补充说明1)。
在特殊情况下,可以通过重新配置系统来调整这些参数。一个有趣的例子是对标记的高分辨率稀疏样本进行成像。通过为斑马鱼幼鱼成像设计的共聚焦LFM可以轻松实现此目标。我们可以加快扫描速度,不要每次扫描一个片段后捕获一个摄像机帧,而是将来自五个连续子片段的所有信号整合到一个摄像机帧中。成像速度增加了5倍的额外好处是可以利用组合的PSF在高分辨率下重建整个神经结构(图1b)。
参考资料:
[1] Denk, W., Strickler, J. H. & Webb, W. W. Two-photon laser scanning fuorescence microscopy. Science 248, 73–76 (1990).
[2] Katona, G. et al. Fast two-photon in vivo imaging with three-dimensional random-access scanning in large tissue volumes. Nat. Methods 9, 201–208 (2012).
[3] Kong, L. et al. Continuous volumetric imaging via an optical phase-locked ultrasound lens. Nat. Methods 12, 759–762 (2015).